Цель работы: изучить реакции электрофильного присоединения, замещения и элиминирования с участием органических соединений.
Реактивы: раствор олеата натрия, бромная вода (разбавленная), анилин, этанол; концентрированная серная кислота, оксид алюминия.
Опыт 1.1. Бромирование непредельных соединений.
В одну пробирку помещают 1 мл водного раствора олеата натрия, в другую – такой же объем дистиллированной воды. В каждую пробирку добавляют по 2 капли водного раствора брома (бромная вода). Сравнивают окраску содержимого пробирок.
Уравнение реакции:
СН3(СН2)7СН=СН(СН2)7СОONa + Br2 ® СН3(СН2)7СНBr-CHBr(СН2)7СОONa
натриевая соль олеиновой к-ты натриевая соль 9,10- дибромстеариновой к-ты
Опыт 1.2. Бромирование ароматических соединений. Образование триброманилина.
В пробирку помещают 2 капли анилина и 2 - 3 мл дистиллированной воды, перемешивают; затем прибавляют по каплям бромную воду. Наблюдают обесцвечивание бромной воды и выпадение белого осадка триброманилина.
Уравнение реакции:
 |
Опыт 1.3. Получение этилена дегидратацией этанола и его бромирование.
В пробирку помещают 0,5 мл этанола, добавляют 15 - 20 капель концентрированной серной кислоты и несколько крупинок оксида алюминия. Пробирку закрывают пробкой с газоотводной трубкой. Конец трубки опускают в пробирку-приёмник с бромной водой. Пробирку с реакционной массой нагревают. Наблюдают постепенное обесцвечивание бромной воды. Нагревание прекращают после того, как будет вынута трубка из пробирки-приёмника.
Внимание! В начале нагревания отгоняется диэтиловый эфир (появляется характерный запах), и только при дальнейшем нагревании – этилен (газ без запаха). Необходимо проследить за тем, чтобы опыт был проведен до конца, пока раствор в первой пробирке не приобретет бурую окраску.
Уравнения реакций:
- получение этилена:
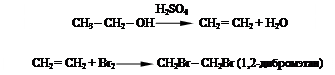 |
- взаимодействие с бромом:
Контрольные вопросы
1. Дайте определение понятия «электрофил». В реакциях какого типа могут принимать участие электрофильные частицы?
2. Приведите общую схему процесса электрофильного присоединения к ненасыщенным соединениям.
3. Лекарственный препарат «Линетол», получаемый из льняного масла, содержит смесь эфиров олеиновой, линолевой и линоленовой кислот. Произойдёт ли обесцвечивание бромной воды при её взаимодействии с водным раствором этого препарата? Ответ поясните.
4. Отличается ли механизм бромирования алкенов и ароматических соединений? Приведите общую схему процесса взаимодействия электрофильной частицы с бензолом.
5. Напишите реакцию бромирования бензойной кислоты. Объясните различие в активирующем и ориентирующем влиянии аминогруппы (оп. 1.2) и карбоксильной группы.
Лабораторная работа № 2. Биологически важные реакции нуклеофильного замещения, нуклеофильного присоединения, нуклеофильного присоединения – элиминирования, радикального замещения
Цель работы: изучить реакции нуклеофильного замещения, присоединения, присоединения – элиминирования, радикального замещения с участием органических соединений.
Реактивы: 10 %-ный раствор гидроксида натрия, 1 %-ный раствор нитрата серебра, 20 %-ный раствор азотной кислоты, насыщенный раствор 2,4-динитрофенилгидразина, формалин, ацетон, насыщенный раствор гидросульфита натрия; 1- бромбутан, гептан; лед; безводный ацетат натрия; гидроксиламин.
Опыт 2.1. Щелочной гидролиз 1-бромбутана.
В пробирку наливают 0,5 мл 1-бромбутана и 2 - 3 раза промывают дистиллированной водой. Для этого в каждую пробирку добавляют по 3 мл воды, смесь интенсивно встряхивают и после расслоения большую часть воды сливают. После промывания приливают 2 мл 10%-ного раствора гидроксида натрия, пробирку закрывают пробкой с обратным холодильником и интенсивно встряхивают. Очень осторожно при встряхивании смесь доводят до кипения. После охлаждения 1 мл щелочного раствора переливают в другую чистую пробирку, подкисляют 20 %-ным раствором азотной кислоты и добавляют несколько капель 1 %- ного раствора нитрата серебра.
Уравнения реакций:
CH3CH2CH2CH2Br + NaОH → CH3CH2CH2CH2OH + NаBr
NaBr + АgNО3 → AgBr↓ + NаNO3
Опыт 2.2. Взаимодействие формальдегида с 2,4- динитрофенилгидразином.
В пробирку помещают 0,5 мл насыщенного раствора 2,4- динитрофенилгидразина, добавляют 5 - 10 капель формалина. Наблюдают появление желтого осадка.
Уравнение реакции:

Опыт 2.3. Взаимодействие ацетона с гидроксиламином.
В пробирку помещают 0,1 г гидрохлорида гидроксиламина и 0,1 г карбоната натрия. Смесь растворяют в 1,0 - 1,5 мл дистиллированной воды. После прекращения выделения углекислого газа раствор охлаждают в ледяной воде. Добавляют при перемешивании 10 капель ацетона. Наблюдают разогревание смеси и выпадение белых кристаллов оксима ацетона.
Уравнения реакций:
2[HO–NH3]+ Cl– + Na2CO3 → 2HO – NH2 + 2NaCl + H2O + CO2↑
 |
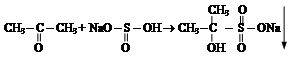
Опыт 2.4. Присоединение гидросульфита натрия к ацетону.
На предметное стекло помещают 1 каплю насыщенного раствора гидросульфита натрия и добавляют 1 каплю ацетона. Рассматривают форму образовавшихся кристаллов.
Уравнение реакции:
Опыт 2.5. Взаимодействие уксусной кислоты с этанолом.
В пробирку помещают 0,1 г безводного ацетата натрия, добавляют 0,5 мл этанола и несколько капель концентрированной серной кислоты. Пробирку осторожно нагревают в течение 20 - 30 с. Содержимое пробирки выливают в фарфоровую чашку с холодной водой. Отмечают появление характерного запаха.
Уравнение реакции этерификации:
2CH3COONa + H2SO4 → 2CH3COOH + Na2SО4
 |
Опыт 2.6. Бромирование предельных углеводородов.
В две кварцевые кюветы помещают по 5 - 10 мл гептана. В каждую кювету добавляют 5 - 10 капель раствора брома в тетрахлориде углерода (до одинаковой окраски). Одну из кювет помещают под источник УФ-света. Через 3 - 4 мин наблюдают окраску содержимого кювет.
Контрольные вопросы
1. Дайте определение понятия «нуклеофил». Приведите схемы бимолекулярного и мономолекулярного механизмов нуклеофильного замещения.
2. По какому механизму (SN2 или SN1) протекает щелочной гидролиз 1-бромбутана? Зависит ли скорость реакции замещения галогена в алкилгалогенидах от природы галогена?
3. Напишите реакцию гидролиза этилацетата в щелочной среде. Является ли этот процесс необратимым?
4. Можно ли использовать реакцию с фенилгидразином для выделения альдегидов и кетонов из трудно разделяемых смесей?
5. По какому механизму протекает галогенирование алканов? Какие жизненно важные процессы в организме протекают по такому же механизму?






