В плазме крови содержится значительное количество небелковых азотсодержащих веществ, к ним относятся аминокислоты, пептиды, мочевина, мочевая кислота, креатин, креатинин, билирубин и т.д.
Все эти вещества называют остаточным азотом, это вещества, остающиеся в растворе после осаждения белков. Количество их в норме составляет 20-65 мг%. При повышении обмена веществ, интенсивной работе количество остаточного азота увеличивается до 100 мг%. Безазотистые органические вещества – глюкоза, липиды, жирные кислоты, пировиноградная кислота, молочная кислота играют роль питательных веществ или являются промежуточными метаболитами.
Минеральные вещества содержатся в виде катионов Na+, K+, Ca2+, Mg2+, Cu2+, анионов Cl-, НСОз- и т.д. или же в составе органических соединений.
Форменные элементы крови
Количество эритроцитов в крови у различных видов животных различно. Отличаются они по содержанию ядра: у птиц и земноводных эритроциты ядерные, а у млекопитающих безъядерные. Основная функция эритроцитов дыхательная, она связана с гемоглобином. Количество эритроцитов составляет у лошади (в млн/мм3) 6-10, коровы – 5,5-10, свиньи – 5,5-9, овцы – 8-16. Содержание гемоглобина составляет 10-15%. Кроме гемоглобина, в эритроцитах содержатся ферменты каталаза, карбоангидраза. Каталаза обеспечивает расщепление перекиси водорода на воду и молекулярный кислород, а карбоангидраза – синтез угольной кислоты из CO2 и H2O в тканевых капиллярах и распад H2CO3 в легочных альвеолах на CO2 и H2O. Таким образом, этот фермент обеспечивает связывание CO2 в тканях и удаление его из крови в альвеолах легких.
Выполнение дыхательной функции эритроцитов связано с гемоглобином. Молекула гемоглобина состоит из четырех субъединиц, в том числе два пептида α-цепи из 141 аминокислотного остатка и два пептида β-цепи из 146 аминокислотных остатка. Эти 4 пептида соединены между собой водородными связями (рис.2.8.). В каждом пептиде содержится гем, связанный с двухвалентным железом (рис.2.11.).
Строение гемоглобина обеспечивает кооперативное связывание 4-х молекул кислорода (O2): каждый гем присоединяет кислород не самостоятельно, а совместно, кооперативно. Кооперативность состоит в том, что каждую молекулу кислорода гемоглобин присоединяет (и отдает) легче, чем предыдущую.
Оксигемоглобин – основное производное гемоглобина, легко диссоциирует на гемоглобин и O2. Скорость прямой и обратной реакций при взаимодействии гемоглобина и O2 зависит от величины парциального давления кислорода в воздухе, с которым контактирует кровь, находясь в капиллярах легочных альвеол.
Количество кислорода, связываемого гемоглобином, содержащимся в 100 мл крови, называется кислородной емкостью крови. Для разных животных она составляет 10,1-19,5 мл.
Оксигенация гемоглобина (Hb) происходит быстрее, чем распад оксигемоглобина:
Hb+ O2 → HbO2 за 0,001 с
Hb2 → Hb + O2 за 0,05 с
В артериальной крови весь гемоглобин находится в виде оксигемоглобина. Это обеспечивается высоким парциальным давлением кислорода в легких, через которые проходит кровь. Во вдыхаемом воздухе содерится 20,9% кислорода, 0,03% CO2. В выдыхаемом – 15,5-16,3% кислорода и 4,1% CO2, или CO2 в 136 раз больше, чем в атмосфере. В легких создаются условия для диффузии O2 в кровь, CO2 – в воздух. В процессе дыхания организм использует около 5% кислорода, содержащегося в воздухе.
Присоединение молекулярного кислорода к гемоглобину не ведет к изменению валентности железа, поэтому этот процесс называется оксигенация, а не окисление. Образуется при оксигенации оксигемоглобин, который в тканях распадается на гемоглобин и O2, после чего O2 усваивается тканями.
При уменьшении парциального давления O2 в воздухе количество HbO2 снижается (гипоксемия), что ведет к гипоксии.
Гемоглобин участвует в переносе CO2. В межтканевых жидкостях парциальное давление CO2 около 8 кПа (60 мм рт.ст.), в венозной крови – около 6 (47 мм рт ст). Эта разница обеспечивает диффузию CO2 из тканей в венозные сосуды. В крови около 20% CO2 соединяется с гемоглобином, около 80% превращается в гидрокарбонат калия КНСО3. B легких гидрокарбонаты разрушаются до H2CO3 с последующим распадом до H2O и CO2, которые удаляются из организма с выдыхаемым воздухом. Эти процессы катализируются ферментом карбоангидразой.
Метгемоглобин Hb-OH образуется под действием различных окислителей, когда Fe++ окисляется до Fe+++ и прочно соединяется с группой ОН. Метгемоглобин не присоединяет кислород. Окислители: метиленовая синь, бензол, нитробензол, анилин. Образование метгемоглобина может привести к смерти.
Карбоксигемоглобин – Hb-CO – соединение с угарным газом. Окись углерода СО имеет сродство к Hb в 300 раз больше, чем кислород. Поэтому даже небольшое количество (0,1%) окиси углерода связывает гемоглобин, превращая его в карбоксигемоглобин и приводит к гибели. В карбоксигемоглобине железо остается 2-х валентным.
Циангемоглобин – Hb-CN – образуется при попадании в кровь синильной кислоты или ее солей. Это ведет к потере способности гемоглобина связывать кислород.
Распад гемоглобина происходит в селезенке, печени, костном мозге. Глобин распадается до аминокислот, а гем превращается в желчные пигменты: биливердин, билирубин, которые далее удаляются из организма с калом (стеркобилин) или с мочей (уробилин).
Лейкоциты – белые клетки крови, выполняют защитные функции, являются продуцентами иммуноглобулинов. Они могут захватывать и переваривать чужеродные тела, попавшие в организм (фагоцитоз).
Тромбоциты – кровяные пластинки, участвуют в процессе свертывания крови. На их поверхности адсорбируются факторы свертывания крови. В первой фазе свертывания крови с участием тромбокиназы и ионов кальция из протромбина образуется тромбин, а во второй фазе под действием фермента тромбина, фибриногена превращается в фибрин.
Лимфа – прозрачная жидкость, содержится в лимфатических сосудах и межклеточном пространстве. По химическому составу близок к плазме крови, отличается лишь более низким содержанием белков.
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Мышечная ткань составляет 40-45 % от массы тела животного. Основная функция мышц – сокращение и расслабление. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую. Обычно различают три типа мышечной ткани: скелетную мускулатуру, сердечную мышцу и гладкую мускулатуру. Особенно развиты и дифференцированы скелетные мышцы, они обеспечивают произвольные движения организма, работу легких и других органов. Сердечная мышца обеспечивает кровообращение, гладкие мышцы, расположенные в стенках внутренних органов, выполняют ряд важных физиологических функций: передвижение химуса, выделение пищеварительных соков, поддержание тонуса сосудов и т.д.
Усиление мышечной работы всегда сопровождается усилением кровоснабжения мышц и интенсификацией обмена веществ в них.
Основной морфологический элемент скелетной мышцы – мышечное волокно, которое имеет характерную поперечную исчерченность. Мышечное волокно – это гигантская многоядерная клетка, покрытая плотной эластичной оболочкой – сарколеммой. Длина мышечного волокна от нескольких мм до десятков см, часто соответствует длине мышцы. Вдоль мышечного волокна, под сарколеммой, расположены пучки миофибрилл. Миофибриллы окружены саркоплазмой, в которой находятся также ядра, митохондрии и различные гранулы.
Мышечные волокна имеют очень много митохондрий, развитую эндоплазматическую сеть. Это обеспечивает доставку в клетки энергетических материалов и удаление из клетки продуктов обмена веществ.
Белки мышечной ткани были предметом изучения многих ученых (А.Я. Данилевский, А.Сент-Дьерри, B.C. Гулевич, C.E. Северин и др.). В.А. Энгельгардт выявил ферментативный распад АТФ и роль в этом процессе мышечных белков, использующих энергию АТФ при сокращении мышечного волокна.
Содержание воды в мышечной ткани составляет 70-80 %, плотный остаток – 20-30 %.
Плотный остаток (сухое вещество) состоит из органических и минеральных веществ. Минеральные вещества: катионы K+, Na+, Ca+, Mg+; анионы хлора, фосфорной кислоты, серной кислоты и т.д. в мышцах находятся в свободном виде и в соединении с белками и другими органическими веществами.
Мышечные волокна – миофибриллы построены из белковых нитей двух типов – толстых и тонких. Основным белком толстых нитей является миозин, а тонких – актин. Миозиновые и актиновые нити – главный компонент всех сократительных систем.
Миозиновые нити образованы белком миозином. Миозин составляет почти половину всех белков скелетной мышцы. Молекула миозина содержит две тяжелые полипептидные цепи с Мм 200000 Да каждой и четыре легкие цепи с Мм 20000 Да. Каждая тяжелая цепь на большей части с С-конца имеет конформацию α-спирали, и обе спирали скручены друг с другом. Противоположные концы каждой цепи (N-концы) имеют глобулярную форму, образуя «головки» молекулы. К каждой из головок присоединены по 2 легкие цепи (рис 15.1.). Миозин катализирует гидролиз АТФ. Энергия гидролиза используется для сокращения мышцы.
Палочкообразные хвосты молекул миозина могут соединяться друг с другом продольно, образуя пучки. Головки выступают на поверхности пучка. Так образуется миозиновые нити саркомера, каждая из которых соединяет около 400 молекул миозина.
Актиновые нити – построены из белков актина, тропомиозина и тропонина. Основу нитей составляют молекулы актина. Актин глобулярный белок с Мм 43000 Да, молекулы соединясь, образуют фибриллярный актин (F-актин). Молекулы F-актина скручены друг с другом (рис. 15.1.). К F-актину могут присоединяться головки миозина, в результате такого взаимодействия многократно увеличивается АТФ-азная активность миозина. Соединения F-актина с миозином называют актомиозином.
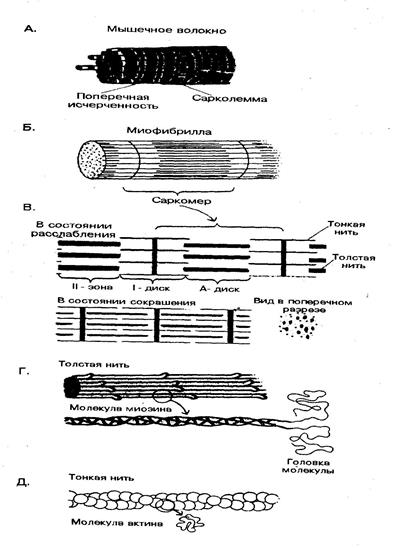
Рис. 15.1. А - мышечное волокно. Б - миофибриллы. В - саркомер в состоянии сокращения и расслабления. Г - молекула миозина. Д -молекула актина
Тропомиозин – белок актиновых нитей имеет форму палочек длиной 40 нм. Они расположены вдоль ленты F-актина, причем каждая молекула тропомиозина соединена с семью молекулами G-(глобулярного) актина.
Тропонин – белок актиновых нитей, имеет глобулярную форму, построен из нескольких субъединиц, связан с тропомиозином и с актином. Одна из субъединиц тропонина содержит кальций-связывающие центры и по структуре сходна с кальмодулином.
Содержание миозина, актина, тропомиозина и тропонина в миофибриллах составляет 55, 25, 15 и 5 % соответственно
Механизм сокращения мышцы
Сокращение мышц – это результат укорочения каждого ее саркомера, которое происходит путем вдвигания актиновых нитей между миозиновыми нитями.
Различают L (изотропный) диск, образованный нитями миозина. Повторяющиеся участки миофибрилл между двумя L-дисками называют саркомерами, их длина 2,5 мкм. При сокращении каждый саркомер укорачивается на 20-50 %, причем это сокращение происходит за счет параллельного скольжения тонких (актин) и толстых (миозин) нитей относительно друг друга.
Скольжение нитей актина и миозина друг относительно друга сопровождается поочередным образованием и разрушением поперечных мостиков между этими нитями за счет конформационных изменений в нитях миозина.
Химическим пусковым механизмом к началу сокращения служит выход катионов кальция Са++ из цистерн. В результате ионы кальция специфически стимулируют Са2+-зависимую АТФ- азную активность актомиозина, в возбужденной мышце происходит распад АТФ на АДФ и неорганический фосфат с освобождением энергии, которая используется для сокращения саркомера. Сигналом для выхода ионов Са++ из цистерн в саркоплазму служит электрический импульс, приходящий из двигательного нерва через моторную пластинку. Такой импульс приводит к разрядке трансмембранного потенциала мышечных волокон. При этом резко увеличивается проницаемость мембран (Т-система) и ионы Ca2+ выходят из цистерн, создавая условия реакции сокращения. С прекращением электрического импульса ионы кальция под действием кальциевого насоса вновь поглощаются Т-системой.
Источником энергии для мышечного сокращения является АТФ. Для сохранения работоспособности должен происходить постоянный ресинтез АТФ. Одним из основных источников ресинтеза АТФ является гликоген мышц. В процессе гликолиза гликоген превращается в молочную кислоту, а энергия, освобождающаяся при этом, идет на синтез АТФ. В мышцах кроме АТФ имеется и другой макроэрг – креатинфосфат, концентрация которого в 4-5 раз больше, чем АТФ.
Продолжительная работа мышц приводит к истощению запасов креатинфосфата и в этих условиях ресинтез АТФ из АДФ может идти за счет гликолиза и тканевого дыхания. При высокой мышечной активности для получения энергии используется главным образом глюкоза. Переход мышц из покоя к работе ведет к увеличению потребления кислорода в ней в 20 раз и более. Одновременно уменьшается отношение АТФ:АДФ, что приводит к активации фосфофруктокиназы и ферментов цикла трикарбоновых кислот. АДФ может также вступать в реакцию перефосфорилирования друг с другом:
АДФ + АДФ => АТФ + АМФ
Это является дополнительным механизмом ресинтеза АТФ.
В период покоя в мышцах происходит накопление креатинфосфата:
АТФ + креатин => креатинфосфат + АДФ
Повышенная нагрузка на мышцы (быстрый бег, поднятие больших грузов) сопровождается учащением дыхания вследствие усиления гликолиза, что приводит к накоплению молочной кислоты в ткани. Молочная кислота используется затем для ресинтеза гликогена в печени и мышечной ткани (гликонеогенез).






