Для идентификации гена молекулу ДНК генома расщепляют с помощью ферментов рестриктаз на куски размером примерно по 15-20 тысяч пар нуклеотидов. Расщепленный таким образом геном подвергается электрофоретическому фракционированию в агарозном геле. После этого фракции ДНК денатурируют нагреванием и переносят из агарозного геля на нитроцеллюлозный фильтр, где их иммобилизуют. Процесс переноса ДНК напоминает промокание (по английский – блоттинг) и называется методом блоттинга по Саузерну. Сущность блоттинга заключается в том, что агарозный гель помещают на фильтровальную бумагу, смоченную в концентрированном солевом растворе; затем на гель накладывают нитроцеллюлозный фильтр и сверху помещают сухую фильтровальную бумагу. Солевой раствор впитывается в сухую бумагу; чтобы это произошло, он должен пройти сквозь агарозный гель и затем через нитроцеллюлозный фильтр. ДНК переносится вместе с раствором, но задерживается нитроцеллюлозой. Иммобилизованную таким образом ДНК можно гибридизовать на месте с радиоактивным зондом. Со специфическим зондом будут гибридизироваться только комплементарные ему фрагменты. Так как зонд радиоактивный, то гибридизацию можно обнаружить с помощью авторадиографии. Каждая комплементарная последовательность проявляется в виде радиоактивной полосы, местоположение которой определяется размером фрагмента ДНК. Схема метода блоттинга по Саузерну представлена на рис. 12.4.

Рис. 12.4. Схема блоттинга по Саузерну: расщепление ДНК генома с помощью рестриктаз на куски 15000-20000 пар нуклеотидов; электрофоретическое разделение этих рестриктаз в агарозном геле, перенос их на нитроцеллюлозный фильтр, гибридизация с ДНК-зондом и выявление образующихся гибридных молекул методом авторадиографии; *)схема переноса (блоттинга).
Метод блоттинга является высокочувствительным и точным и широко применяется в криминалистике, медицине, ветеринарии. В настоящее время метод молекулярной гибридизации разработан для диагностики инфекционных болезней сельскохозяйственных животных, например для обнаружения возбудителя сибирской язвы, бруцеллеза, туберкулеза, ящура, чумы свиней, чумы птиц, энтеровирусов и т.д. Этот метод является» перспективным для изучения племенных качеств животных. Он имеет преимущества перед принятым сегодня в селекции методом изучения маркеров белкового полиморфизма.
Считают, что метод ДНК-гибридизации может успешно использоваться в селекции быков, так как геном быков можно разделить на гены, которые в дальнейшем выявляются блоттингом. При этом необходимо выделить около 75 фрагментов ДНК, чтобы оценить геном по признаку молочной продуктивности.
В последние годы разрабатывается новый метод анализа ДНК, так называемая "геномная дактилоскопия". Геномная дактилоскопия включает следующие этапы: выделение ДНК, фрагментации ее с помощью ферментов - рестриктаз, фракционирование с помощью электрофореза в геле. Фрагменты ДНК, содержащие гипервариабельные участки, выявляют с помощью специального зонда – "пробы Джеффриса", с которой они связываются путем гибридизации. Участки гибридизации выявляются путем авторадиографии.
Исследования показали, что в этой методике в качестве радиоактивного зонда может быть использована ДНК, выделенная из бактериофага Ml3. ДНК этого бактериофага содержит еще один тип гипервариабельной последовательности, который найден также и в геноме человека. Принцип строения этой гипервариабельной последовательности в общих чертах сходен со строением минисателлитной ДНК Джеффриса. Использование этой новой пробы для генной "дактилоскопии" показало ее высокую эффективность и пригодность для решения многих задач. Дело в том, что эти гипервариабельные последовательности обнаружены у разных представителей живой природы – человека, животных, растений и бактерий, а потому ДНК-зонд бактериофага M13 может быть использован в широких масштабах. Например, для идентификации личности, для установления родства любых живых существ. Метод дает возможность решать вопросы генетики и селекции животных, вести отбор по полезным признакам; используя этот метод можно вести генную паспортизацию отдельных высокопродуктивных животных, анализировать родословную и полученные сведения использовать для направленной селекции.
Существует еще одна разновидность гибридизационного анализа ДНК – это метод точечной (дот) гибридизации (рис.9), который выполняется путем внесения исследуемых образцов ДНК в денатурированном состоянии на капроновые мембранные фильтры в виде точек. Например (рис. 12.5), ДНК микобактерий туберкулеза крупного рогатого скота в количестве 3 мкл (1,8 мкг/мл) в виде точек наносится в квадраты (1,5 х 1,5 см).
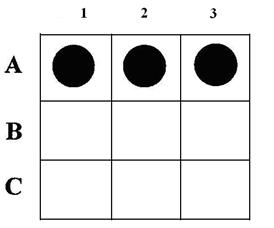
Рис. 12.5. Дот-гибридизация ДНК-зонда M.bovis: А: 1 - M.bovis: 2,3, - ДНК из пораженной туберкулезом ткани; В: 1,2,3 - ДНК, выделенная из тканей здоровых животных; С: 1 - ДНК возбудителя бруцеллеза;
2 - ДНК возбудителя листерий;
3 - ДНК M. fortuitum.
Одноцепочечные молекулы ДНК (денатурированные) адсорбируются на мембране и фиксируются. После этого на фильтр наносится ДНК-зонд, меченный радиоактивным фосфором, то есть одноцепочечная молекула M.bovis, меченая P32. Поскольку в данном случае азотистые основания молекул ДНК M.bovis и меченого P32 ДНК-зонда комплементарны, то происходит связывание азотистых оснований нитей ДНК и ДНК-зонда с образованием двойной спирали. После этого несвязанные молекулы ДНК-зонда отмываются и образующиеся гибридные молекулы выявляются путем радиоавтографии.
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР)
Из молекулярных методов диагностики наибольшее распространение получила полимеразная цепная реакция (ПЦР). Предложенный в 1983 году американским биохимиком Керри Маллисом метод ПЦР в корне изменил подход в молекулярной диагностике наследственных и инфекционных заболеваний, судебно-медицинской экспертизе вещественных доказательств, установлении родства и анализе родословных, систематике микроорганизмов, растений, животных и т.д. За изобретение ПЦР К.Маллис в 1993 г. был удостоен Нобелевской премии.
Полимеразная цепная реакция – наиболее точный метод на сегодняшний день метод исследований по генной диагностики. Принцип метода заключается в том, что по данным банка генов различных организмов выявляется специфический для данного организма (бактериальной клетки, вируса) ген – участок молекулы ДНК, несущий информацию для синтеза одного белка. К участкам данного гена синтезируются затравки - праймеры, длиной 15-25 нуклеотидов.
ПЦР является надежным, высокочувствительным методом, хорошо защищенным от ложноположительных и ложноотрицательных результатов. В модельной системе при диагностике вирусных инфекций удается регистрировать порядка 10 геномов в пробе (Виноградская P.P. и др., 1991 г.). Считают, что предел чувствительности ПЦР-диагностикума при условии использования 100 мкл необогащенного клинического образца в качестве пробы составляет 10-10 возбудителей в 1 мл. Такой чувствительности достигают только культуральные методы диагностики. ПЦР имеет преимущество перед культуральными методами для обнаружения возбудителей болезней, которые не удается выращивать в лабораторных условиях.
Суть полимеразной цепной реакции (рис. 12.6) заключается в том, что молекулу ДНК подвергают температурному плавлению, то есть нагревают до 90-94о C, что ведет к денатурации – разрушению водородных связей между азотистыми основаниями двойной спирали, а затем охлаждают (отжиг) до 52°С в присутствии праймера, фермента ДНК-полимеразы и всех четырех дезокситрифосфатов.

Рис. 12.6 Схематическое изображение амплификации молекулы ДНК при плавлении (денатурации) и отжиге (синтезе) новой молекулы ДНК в присутствии затравки (праймера), фермента ДНК-полимеразы и трифосфатов.
▬ праймер
▪ ▪ ▪ ▪ новосинтезированная молекула ДНК
Последующее повышение температуры до 70-72°С приводит к синтезу новой молекулы ДНК, комплементарной к матричной. Эту процедуру плавления, отжига и синтеза ДНК повторяют многократно, в результате чего количество выбранного фрагмента ДНК увеличивается в геометрической прогрессии (рис. 12.6).
Специфичность метода уникальна, так как она обусловлена последовательностью нуклеотидов затравки (праймера) и в зависимости от цели исследования можно выявить вид, группу видов или род микроба. Так, использовав в качестве праймера олигонуклеотид гена gro El микобактерий можно установить наличие в образце представителей любого из 30 видов рода Mycobacteria; праймера IS 986 (или IS6110) – представителей любого из четырех видов – возбудителей туберкулеза человека, относящихся к M.tuberculosis Complex; праймер к IS 900 выявит один единственный вид – Mycobacterium paratuberculosis (Ланцев В.А и др., 1993 г.).
Продолжительность реакции определяется числом циклов, необходимых для синтеза ДНК-амплификата в количестве, достаточном для дальнейшего исследования или индикации. Индикация может быть осуществлена с помощью электрофореза или с помощью меченого ДНК-зонда.






