Рациональная номенклатура ферментов составляется путем прибавления к латинскому корню названия субстрата, на который действует фермент, или к названию процесса, катализируемого ферментом, окончания "аза".
Например, фермент, воздействующий на крахмал (amylum), называется амилаза; мочевину (urea) – уреаза; фенолы – фенолаза и т.д.
Кроме рационального названия сохранились ранее появившиеся термины: пепсин, трипсин.
В 1961 г. принята новая международная классификация, в основу которой принят тип катализируемой реакции.
В настоящее время известно около 3000 различных ферментов. Классификацию их проводят по типу их действия. Различают 6 классов ферментов:
1. Оксидоредуктазы – окислительно-восстановительные
ферменты; катализируют биологическое окисление.
2. Трансферазы – катализируют реакции переноса различных химических групп от одной молекулы (донора) к другой молекуле (акцептору).
3. Гидролазы – осуществляют химические превращения веществ с участием молекулы воды.
4. Лиазы – отщепляют от субстратов ту или иную группу негидролитическим путем.
5. Изомеразы – осуществляют изомерные превращения соединений.
6. Лигазы (синтетазы) – катализируют реакции синтеза, сопровождающиеся отщеплением фосфорной кислоты от АТФ или другого трифосфата.
I класс. Оксидоредуктазы – это ферменты окислительно-восстановительных реакций, лежащих в основе биологического окисления. Название ферментов составляется по следующей форме: название субстрата (донора), от которого отщепляются атомы водорода (электроны), название акцептора, на который переносятся атомы водорода и оканчивается названием "оксидоредуктаза": например, лактат: НАД-оксидоредуктаза.
Различают следующие подклассы:
1) аэробные дегидрогеназы, которые переносят электроны и протоныводорода с окисляемого субстрата на кислород:
H2S + O2  S окисленная + H2O2
S окисленная + H2O2
сероводород
к ним относятся ферменты оксидазы;
2) анаэробные дегидрогеназы переносят электроны и протоны водорода с окисляемого на другой субстрат. К ним относятся пиридинзависимые и флавинзависимые дегидрогеназы. Например, окисление молочной кислоты происходит под действием лактатдегидрогеназы, при этом НАД восстанавливается в НАДН2:

молочная кислота пировиноградная кислота
Окисление янтарной кислоты происходит поддействием сукцинатдегидоогеназы, при этом ФАД восстанавливается в ФАДН2.
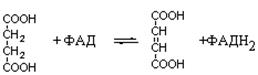
янтарная кислота фумаровая кислота
3) электронтранспортазы – переносчики электронов. К ним относятся цитохромные ферменты, цитохромоксидазы дыхательной цепи митохондрий
4) пероксидаза и каталаза. Пероксидаза катализирует окисление субстрата перекисью водорода. Например, под действием пероксидазы сероводород окисляется с участием перекиси водорода:

 H2 S + H2O2 S окисленная + 2H2O
H2 S + H2O2 S окисленная + 2H2O
Каталаза в организме животных разрушает перекись водорода на воду и молекулярный кислород:

 2H2O2 2H2O + O2
2H2O2 2H2O + O2
Каталаза обезвреживает действие перекиси и является источником молекулярного кислорода в тканях.
II класс. Трансферазы – катализируют реакции переноса атомов и групп атомов, включают следующие подклассы:
1) Аминоферазы – ферменты, переносящие аминогруппы с одного вещества на другое. Коферментом является производное витамина B6 (пиридоксин): например, глутаминовая кислота отдает аминную группу на пируват, в результате синтезируется аланин и образуется а-кетоглутаровая кислота.

глутаминовая пируват α - кетоглутаровая аланин
кислота кислота
Пиридоксин – фермент, осуществляющий эту реакцию, называется 1-глутамил:пируватаминотрансфераза или по старой номенклатуре – аминофераза.
2) Ацилтрансферазы – ускоряют перенос ацилов (остатков карбоновых кислот) на аминокислоты, спирты и другие соединения. Например, синтез ацетилхолина осуществляется с участием фермента холинацетилтрансферазы:

3) Фосфотрансферазы – ферменты, ускоряющие реакцию переноса остатка фосфорной кислоты. Донором фосфатных остатков чаще всего является АТФ. Например, гексокиназа ускоряет перенос остатка фосфорной кислоты на глюкозу:

α-D -глюкоза глюкозо-6-фосфат
4) Метилферазы - ферменты, переносящие метильную группу с одного соединения на другое: например, при синтезе креатина донором метильной группы является метионин.
5) Глюкозилтрансферазы - переносчики глюкозидных
остатков:
 11(C6H12O6) + УДФ - глюкоза (n+1) (C6H12O6) + УДФ
11(C6H12O6) + УДФ - глюкоза (n+1) (C6H12O6) + УДФ
к ним относятся гликогенсинтазы, глюкозилтрансферазы, фосфорибозилтрансферазы и т.д.
6) Алкилтрансферазы – переносчики спиртовых остатков. К ним относятся холинтрансфераза, фосфатилдиэтаноламин-трансфераза и др.

III класс. Гидролазы - разрывают внутримолекулярные связи путем присоединения элементов воды:
 R - R1 + HOH R - H + R1 - ОН
R - R1 + HOH R - H + R1 - ОН
К ним относятся следующие подклассы:
1) Эстеразы - ферменты, гидролизирующие эфирные связи по схеме:
 R1-0-R2+ HOH R1-H+ R2-OH
R1-0-R2+ HOH R1-H+ R2-OH
Например, фосфодиэстеразы - гидролизуют фосфорные эфиры:
 Диацилглицерин 3-фосфорная кислота + HOH диацилглицерин + H3PO4.
Диацилглицерин 3-фосфорная кислота + HOH диацилглицерин + H3PO4.
К этому подклассу относятся: фосфатазы (кислая, щелочная), глюкозо-6-глюкозо-1-фосфатаза, РНК-аза и др.
Карбоксиэстеразы – гидролизуют сложные эфирные связи:

тристеарин глицерин стеариновая
кислота
К этим ферментам относятся липазы, лецитиназы, простые эстеразы и т.д.
Сульфоэстеразы – гидролизуют сернокислые эфиры по следующей схеме:
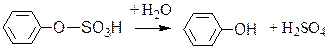
фенолсерная кислота фенол серная кислота
2) Гликозидазы – гидролизуют гликозидные связи, к ним относятся α- и β-амилазы, мальтаза, лактаза, сахараза.
3) Пептидазы. Различают эндопептидазы – пепсин, трипсин, хемотрипсин; экзопептидазы – аминопептидаза, карбоксипептидаза, дипептидазы, трипептидазы.
Пептидазы гидролизуют пептидные связи по следующей реакции:
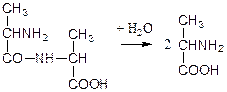
аланилаланин аланин
В результате гидролиза образуется две молекулы аланина.
4) Амидазы – ферменты, гидролизующие амидные связи пуриновых и пиримидиновых оснований, амидов аминокислот и
аргинина. Примеры:
 а) Аденин + H2O гипоксантин + NH3
а) Аденин + H2O гипоксантин + NH3
пуриндезаминаза

глутаминовая глутамин
кислота

аргинин мочевина орнитин
5) Полифосфатазы - гидролизуют фосфорноангидридные связи:
АТФаза
 АТФ + H2O АДФ + H3PO4
АТФ + H2O АДФ + H3PO4
К этой группе относятся Na+, K+, Mg2+-ATФaзa, и др.
IV класс. Лиазы – ферменты, расщепляющие связи без Участия воды, разрывая при этом C-C связи, C-N связи, C-O связи. К ним относятся ферменты альдолаза, декарбоксилаза и другие. Например, альдолаза разрывает C-C связи гексозы (1,6 -дифосфофруктозы) с образованием двух триоз, фосфодиоксиацетона и фосфоглицеринового альдегида:
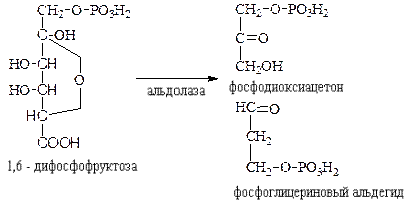
V класс. Изомеразы: катализируют изомеризацию, изомерные превращения молекул, например, молекулы глюкозы во фруктозу. Мутазы изменяют местоположение различных групп или атомов в молекуле. К ним относятся: фосфоглицеромутаза, фосфоглюкомутаза, фосфофруктомутаза и т.д. Например, фосфодиоксиацетон под действием изомеразы превращается в фосфоглицериновый альдегид:
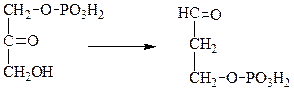
фосфодиоксиацетон фосфоглицериновый альдегид
VI класс. Лигазы (синтетазы) – ферменты, катализирующие присоединение молекул друг к другу. Например:
 аминокислота + тРНК аминоацил-тРНК
аминокислота + тРНК аминоацил-тРНК
Сюда относятся ферменты: ДНК-полимеразы, РНК-полимеразы, ферменты, катализирующие синтез белков и т.д.
Применение ферментов.
Ферменты получили широкое применение в животноводстве и ветеринарии или в виде свободных ферментных препаратов или же в виде иммобилизованных ферментов. Иммобилизацию ферментов производят путем прикрепления к структурам, не растворимым в воде. Иммобилизованные ферменты легко отделяются от реакционной среды, что позволяет вести процесс непрерывно. Носителем фермента могут быть селикагель, окись алюминия, активированный уголь, полисахариды, иониты, органические полимеры. Связывание фермента может осуществляться методом ковалентного связывания, электростатического связывания, сополимеризации или же фермент может быть включен в полимер, инкапсулирован, включен в липосомы. Для связывания фермента важно при этом сохранение активного центра фермента. В качестве мостика часто используют глутаровый альдегид, бромистый циан (CNBr). Молекулу фермента можно заключить в капсулы, ограниченные мембраной, фиксировать в полимерах, при этом наиболее удобным является полимеризация в полиэтиленгликоле (ПЭГ), в полиакриламиде (ПААГ). Сейчас добились функционирования фермента в течение одного месяца при 60-700C. Использоваться иммобилизованные ферменты могут для аналитических целей, для получения биологических продуктов или же для лечения (в медицине, ветеринарии).
1. Применение в аналитических целях. Существует два типа устройств с иммобилизованными ферментами, применяемые в аналитических целях – ферментные электроды и автоматические
анализаторы.
Ферментный электрод – это датчик, способный генерировать электрический потенциал в результате реакции, катализируемый иммобилизованным ферментом. Разработаны ферментные электроды для определения глюкозы, мочевины, аминокислот, спирта, пенициллина и ряда других веществ.
Например, глюкозочувствительный ферментный электрод содержит иммобилизованную глюкозооксидазу, которая катализирует удаление протонов водорода из раствора со скоростью, зависящей от концентрации в среде глюкозы:

то есть, окисление альдегидов происходит путем дегидрирования. Альдегиды существуют в водных растворах в форме гидратов:

атом водорода затем переходит через пленку к платиновому электроду, меняет потенциал (рН), что и регистрируется прибором. По этому принципу разработан прибор для определения сахара в крови. Прибор напоминает авторучку, где имеется пластинка для нанесения пробы крови (каплю) и экран, указывающий содержание глюкозы в процентах в пробе. Результат получается через 30 секунд после нанесения пробы. В приборе иммобилизованный фермент реагирует с глюкозой, электрический ток (потенциал) показывает на экране процент глюкозы.
По этому же принципу сейчас пользуются индикаторной бумагой, например, для определения глюкозы в моче больных сахарным диабетом: на индикаторную бумагу наносится капля мочи, и, если в ней содержится глюкоза, то под действием иммобилизованного фермента глюкоза окисляется в глюконовую кислоту, что в свою очередь изменяет рН. Показатель очень удобен для контроля состояния больных и назначения лечения.
Разрабатываются подобные приборы для определения холестерина в крови (показатель атеросклероза) и других соединений.
2. Применение ферментов с лечебной целью. Для этого выпускаются ферментные препараты или свободные, или же иммобилизованные. Ферментные препараты, применяемые преимущественно при гнойно-некротических процессах: трипсин, химотрипсин, химопсин, террилитин (Asp.terricola), РНК-аза, ДНК-аза, коллагеназа, аспераза, лизоамидаза (бактериальный фермент), профезим, карипазин (из папайи), лекозим. Ферментные препараты, улучшающие процессы пищеварения: пепсин, сок желудочный, пепсидал, аболин, панкреатин, ораза, сализим, нигедаза (липолитический фермент).
Для применения в ветеринарии выпускаются иммобилизованные ферменты: фермсорб – сополимер метакриловой кислоты и триэтиленгликоль – диметакрилата с сорбированными на нем литическими ферментами. Происходит лизис клеточной оболочки и сорбции полимерной матрицей патогенных микроорганизмов. При диарее телят различной этиологии препарат дают внутрь с кипяченой водой 3 раза в день. Полиферм – сополимер метакриловой кислоты и триэтиленгликоль диметакриловой кислоты с сорбированными в нем протеолитическими ферментами.
При лечении желудочно-кишечных болезней молодняка успешно применяют протеолитические ферменты – пепсин, амилосубтилин, протосубтилин, иммобилизованные ферменты профезим, иммозим. Лизосубтилин – универсальный протеолитический фермент производится у нас в стране в больших объемах.
Лизоцим, гликозидаза, коллитин – бактериолитические ферменты, применяют при желудочно-кишечных заболеваниях молодняка сельскохозяйственных животных.
Фермент гиалуронидаза (лидаза) разрушает гиалуроновую кислоту, тем самым улучшает проницаемость тканей.
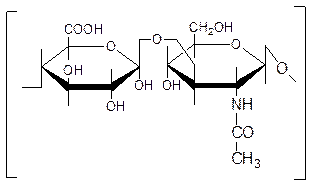
Гиалуроновая кислота
Полимер из глюкуроновой кислоты + ацетилгюкозамина является межклеточным веществом, содержится в структуре кожи, связок, регулирует поступление различных соединений, питательных веществ.
Ферменты – ДНК-аза, РНК-аза применяются для разложения слизистой массы дыхательных путей – для ингаляции, виде салфетки, пропитанной ферментами гиалуронидазой, ДНК-азой, РНК-азой.
Применение ферментных препаратов в кормлении животных. В настоящее время в кормлении животных и кормопроизводстве широкое распространение находят ферментные препараты, с помощью которых можно существенно улучшить переваримость и усвоение организмом питательных веществ корма, а также ускорить процессы пищеварения. Для этой цели промышленность выпускает различные ферментные препараты бактерий и грибков. Их получают путем глубинного (Г) или поверхностного (II) культивирования, затем высушивают путём распылительной сушки. Благодаря этому активность фермента повышается по сравнению с исходной в 3, 10, 15 раз, что обозначается как 3х, 10x, 15х.
Широкое применение получили ферментные препараты амилосубтилин и протосубтилин, полученные выращиванием специальных штаммов Bacillus subtilis.
Амилосубтилин ГЗх содержит альфа-амилазу, протеазы, бета-глюказу. Стандартизируется по альфа-амилазной активности.
Протосубтилин ГЗх, содержит те же ферменты, но стандартизируется по нейтральной протеазе.
Различные штаммы Aspergillus awamori служат продуцентами для глюкаваморина, пектаварина, ксилаваморина.
Глюкаваморин П10х содержит альфа-амилазу декстриназу, мальтазу, глюкоамилазу, кислую протеазу, гемицеллюлазу, стандартизируется по декстриназе.
Пектаваморин ГЗх содержит полигалактуроназу, полиметилгалактуроназу, пектинэстеразу, кислую протеазу, стандартизируется по общей пектолитической активности.
Ксилаваморин ГЗх содержит гемицеллюлазу и пектиназу, стандартизируется по гемицеллюлазной активности.
Из культуры Aspergillus oryzae получают препарат амилоризин П10х, который содержит альфа-амилазу, декстриназу, мальтазу, протеазу, стандартизируется по альфа-амилазе.
Кроме того, производят ферментные препараты пектофоетидин ГЗх, пектоклостридин, пектонигрин и т.д.
Добавление указанных ферментных препаратов в корм животных значительно улучшает переваримость грубых кормов, усвоение питательных веществ и увеличение продуктивности.






