Липиды (от греч. lipos — жир) — это гетерогенная группа органических веществ, не растворимых в воде, но растворимых в аполярных органических растворителях (хлороформ, бензол, эфир, ацетон, этанол и др.).
Содержание липидов в организме, как правило, составляет 10—20 % от массы тела и зависит от вида тканей, возраста, пола животного, количества и состава пищи.
Биологические функции липидов
1. Структурная. Участвуют в структурно-функциональной организации мембраннных систем клетки. В качестве структурных компонентов клетки участвуют в передаче нервного импульса (в нервной ткани содержится 20—25 % фосфолипидов).
2. Энергетическая. Липиды являются резервом энергетического топлива. Так, например, триацилглицериды (ТАГ) при расщеплении 1 г дают 38,9 кДж энергии (это в 2,5 раза больше, чем при сгорании такого же количества углеводов или белков).
Липиды так же, как белки и углеводы, являются источником эндогенной воды. При окислении 100 г жира образуется 107,1 г воды, углеводов — 55,5 г, белков — 41,3 г.
3. Защитная. Жировая ткань защищает внутренние органы от травм. Жиры участвуют в образовании липидных компонентов кожи позвоночных, восковой пленки на поверхности листьев и плодов, предохраняющей их от потери воды, в образовании клеточных стенок бактерий и кутикулы насекомых.
4. Терморегуляторная. Жиры участвуют в процессах терморегуляции, защищая внутренние органы от охлаждения.
5. Транспортная. Транспортируют жирорастворимые компоненты в процессе всасывания.
Классификация липидов
До настоящего времени единой строго научной классификации липидов нет, что объясняется многообразием структурных компонентов, входящих в их состав. Существует несколько классификаций.
В соответствии со структурной классификацией липиды подразделяют на однокомпонентные (липидные мономеры) и многокомпонентные. В свою очередь многокомпонентные липиды подразделяются на простые и сложные (липоиды).
К липидным мономерам относятся высшие углеводороды, высшие алифатические спирты, альдегиды, кетоны, изопреноиды и их производные, высшие аминоспирты (сфингозины), жирные кислоты, высшие полиолы.
Простые многокомпонентные липиды — это эфиры высокомолекулярных алкоголей и жирных кислот. К ним относятся ацилглицери-ды (жиры), воски, стериды.
Сложные липиды (липоиды) являются сложными эфирами, содержащими также азотистые основания и радикалы фосфорной кислоты. К ним относятся липопротеиды, фосфо- и гликолипиды.
По степени полярности липиды подразделяются на нейтральные (неполярные) и полярные. Нейтральные липиды — это нейтральные жиры.
По отношению к щелочам выделяют омыляемые и неомыля-емые липиды. Омыляемая фракция липидов подвергается щелочному гидролизу. Неомыляемые липиды — соединения, не подвергающиеся щелочному гидролизу: липидные мономеры, стерины, простые эфиры, жирорастворимые витамины.
По расположению в тканях и функциям липиды подразделяются на структурные (плазматические) и запасные (депозитные). Структурные липиды входят в состав клеточных мембран и протоплазмы. К ним относятся фосфо-, глико- и сульфолипиды. Депозитные липиды являются лабильной составной частью тканей, их содержание находится в прямой зависимости от упитанности организма. Ряд авторов делит липиды на три основные группы: нейтральные липиды, фосфолипиды и сфинголипиды.
Представители липидных мономеров
Углеводороды
Высшие углеводороды являются липидами простейшего типа, например: С30Н50 — сквален, C18H32 — пристан, С|8Н32 — гадлузенен, С10Н22 — декан, С28Н46 - цеторхинен.
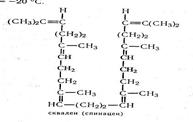
Сквален — алифатический ненасыщенный углеводород с шестью двойными связями, бесцветное подвижное масло; М = 410,7, (кт = 213 °С, t = -20 °Г.
Сквален является промежуточным соединением в биосинтезе холестерина. Содержится в жирах печени некоторых морских животных и рыб (акул, скатов, химер).
Каротиноиды (от лат. carota — морковь) — углеводороды состава С40Н56. Одной из характерных особенностей каротиноидов является наличие в них большого числа сопряженных двойных связей, образующих хромоформные группы, от которых зависит окраска тканей.
Наиболее важными являются а-, β -, γ -каротины, которые содержатся в растениях и служат провитаминами жирорастворимого витамина А. а-Каротин отличается от β -изомера положением двойной связи в одном из циклов, расположенных по концам молекулы. В отличие от а- и β-изомеров γ-каротин имеет только один цикл.
Группа каротиноидов включает 65—70 природных пигментов. Они содержатся в большинстве растений, в животных организмах их концентрация низкая. Все натуральные каротиноиды рассматриваются как производные ликопина — каротиноида, который характерен для плодов томатов, некоторых ягод и фруктов. Наиболее известными пигментами являются каротины, придающие окраску моркови. Криптоксантин и цеоксантин — это каротины, определяющие окраску семян желтой кукурузы; ликопин — каротиноид, обусловливающий окраску плодов томата; лютеин — желтый пигмент, содержащийся наряду с каротинами в зеленых частях растений; цитроксантин — это каротиноид, который содержится в кожуре цитрусовых плодов; фукоксантин характерен для бурых водорослей и принимает участие в процессе фотосинтеза в качестве вспомогательного пигмента.
К липидным мономерам также относятся хлорофиллы — пигменты, придающие зеленую окраску растениям и участвующие в процессе фотосинтеза.
Высшие полиолы (спирты)
Высшие полиолы (спирты) — это липидные мономеры, которые могут входить в состав многокомпонентных липидов; они под разделяются на насыщенные и ненасыщенные.
Насыщенные спирты
Октиловый, Дециловый,Лауриновый,
додециловый, Миристиновый,,тетрадециловый
Цетиловый,,гексадециловый
Стеариновый, октадециловый, батиловый
Мирициловый
Ненасыщенные спирты
Каприновый,,атрофиловый,Макроцефаловый,
децениловый,Додецениловый,
одонтоцефалиновый,Тетрадецениловый,
физетериловый, Гексадецениловый
зоомариновый,Октадецениловый
олеиловый, селахиловый
Аминоспирты
Аминоспирты — это спирты, которые содержат аминогруппу, могут входить в состав липидов и являться липидными мономерами. Характерным аминоспиртом является сфингозин: CH2(CH3)12—СН=СН—СН—СН—СН2
ОН NH2 ОН
Сфингозин в виде церамин-1^-ацильного производного входит в состав сложных липидов, а именно сфинголипидов — типичных компонентов высокоорганизованных тканей, особенно тканей нервной системы. В процессе миелинизации они накапливаются в сером и белом веществе головного мозга; содержатся в оболочках аксонов периферической нервной системы, мембранах эритроцитов, плазме крови, печени, легких, селезенке, почках.
Холин относят к группе витаминов В, синтезируется из метионина и аминоэтилового спирта (этаноламина), является сильным основанием и входит в состав лецитинов. Структурная формула холина
Жирные кислоты
Жирные кислоты подразделяются на насыщенные и ненасыщенные.
Согласно Женевской номенклатуре систематическое название жирных кислот чаще всего образуется путем добавления к названию углеводорода окончания -овая. Насыщенные кислоты при этом имеют окончание -ановая (например, октановая), а ненасыщенные -еновая (например, октадеценовая — олеиновая кислота).
Общие сокращенные формулы для жирных кислот Сrm» Сm:r, где т — число атомов С, включая атом С карбоксильной группы; k — число кратных связей.
Атомы углерода нумеруются, начиная от карбоксильной группы, содержащей атом углерода (углерод 1). Атом углерода, следующий за карбоксильной группой (углерод 2), называют также а-углеродом, атом углерода 3 - β-углеродом, а углерод концевой метильной группы (углерод п) — ω-углеродом.
Для указания числа двойных связей и их положения принимаются различные обозначения:
• символ Δ с цифрой, указывающей номер атома углерода, означает положение первой двойной связи, при этом нумерация идет от атома углерода карбоксильной группы, например, Δ 9 означает, что двойная связь в молекуле жирной кислоты находится между атомами 9 и 10 от карбоксильной группы;
• символ ω обозначает обратный ход нумерации, со обозначается первый атом углеродного радикала, например, ω 9 показывает, что двойная связь между 9-м и 10-м атомами углерода, если их отсчитывать с ω -конца.
В молекулы жирных кислот животных организмов в процессе метаболизма могут входить дополнительные двойные связи, но всегда между уже имеющимися двойной связью (например,ω9,ω6, ωЗ) и карбоксильным углеродом; это позволяет разделить жирные кислоты животного происхождения на три семейства — ω9,ω6, ω3
Насыщенные жирные кислоты
Насыщенными жирными кислотами называются карбоновые кислоты, углеродные цепи которых не содержат двойных связей.
Насыщенные жирные кислоты (в отличие от ненасыщенных) устойчивы к действию окислителей.
Углеродные цепи насыщенных кислот имеют форму зигзагообразной линии, когда они вытянуты, как, например, при низких температурах. При высоких температурах происходит поворот вокруг ряда связей, приводящий к укорочению цепей, именно поэтому при повышении температуры биомембраны становятся тоньше.
Насыщенные жирные кислоты характерны для твердых жиров, ненасыщенные — для жидких.
Ненасыщенные жирные кислоты
Ненасыщенные жирные кислоты — это кислоты, содержащие в углеродном скелете двойные (кратные) связи.
В зависимости от степени ненасыщенности (количество двойных связей) их подразделяют:
— на мононенасыщенные (моноэтеноидные, моноеновые) кислоты — содержат одну двойную связь;
• — полиненасыщенные (полиэтеноидные, полиеновые) кислоты — содержат более двух двойных связей. Некоторые авторы относят к полиеновым кислотам ненасыщенные жирные кислоты, содержащие три и более кратных связей.
У ненасыщенных жирных кислот наблюдается геометрическая изомерия, обусловленная различием в ориентации атомов или групп относительно двойной связи. Если ацильные цепи располагаются с одной стороны от двойной связи, образуется цис-конфитурация, характерная, например, для олеиновой кислоты; если же они располагаются по разные стороны от двойной связи, то образуется транс-конфигу рация.
К ненасыщенным жирным кислотам относятся оксикислоты, например рицинолевая кислота, имеющая гидроксильную группу у атома С12:
С21Н41СООН
СН3-(СН2)7-СН=СН-(СН2)П-СООН
Циклические ненасыщенные жирные кислоты
Молекулы циклических ненасыщенных кислот содержат мало реакционноспособные углеродные циклы. Характерными примерами являются гиднокарповая и хаульмугровая кислоты.
Эти кислоты входят в состав масел тропических растений, используемых для лечения проказы и туберкулеза.
Незаменимые {эссенциальные) жирные кислоты
В 1928 г. Эванс и Бэрр обнаружили, что у крыс, получающих обезжиренный, но содержащий витамины А и D рацион, наблюдается замедление роста, снижение плодовитости, чешуйчатый дерматит, некроз хвоста, поражение мочевой системы. В своих работах они показали, что данные синдромы можно лечить, добавляя в пищу незаменимые жирные кислоты.
Незаменимые (эссенциальные) жирные кислоты — это кислоты, которые не синтезируются организмом человека, а поступают в него с пищей. Незаменимыми кислотами являются:
- линолевая С17Н31СООН (две двойные связи),
— линоленовая С17Н29СООН (три двойные связи),
— арахидоновая С19Н31СООН (четыре двойные связи),
Линолевая и линоленовая кислоты не синтезируются в организме человека, арахидоновая — синтезируется из линолевой с помощью витамина В6. Эти кислоты называются витамином F (от англ. fat — жир) и входят в состав растительных масел.
У людей, в питании которых отсутствуют незаменимые жирные кислоты, развивается чешуйчатый дерматит, нарушение транспорта липидов. Во избежание этих нарушений необходимо, чтобына долю незаменимых жирных кислот приходилось до 2 % от общей калорийности. Незаменимые жирные кислоты используются организмом в качестве предшественников биосинтеза простагландинов и лейкотриенов, участвуют в построении клеточных мембран, регулировании обмена веществ в клетках, кровяного давления, агрегации тромбоцитов, выводят из организма избыточное количество холестерина, уменьшая таким образом вероятность заболевания атеросклерозом, повышают эластичность стенок кровеносных сосудов. Наибольшей активностью обладает арахидоновая кислота, промежуточной — линолевая; активность линоленовой кислоты в 8—10 раз ниже активности линолевой кислоты.
а-Линоленовая кислота является ω-З-кислотой, линолевая, арахидоновая и γлиноленовая — ω-6-кислотами, последние входят в семейство омега-6.
Линолевая кислота входит в состав многих растительных масел, содержится в пшенице, арахисе, семенах хлопчатника, сое. Арахидоновая кислота обнаруживается вместе с линолевой кислотой, особенно в арахисовом масле; является важным элементом фосфоли-пидов животных. а-Линоленовая кислота также обнаруживается вместе с линолевой кислотой, особенно в льняном масле, γлиноле-новая — характерна для розового масла.
Рекомендуемое Институтом питания РАМН соотношение ω-6: ω-3 в рационе для здорового человека составляет 10: 1, для лечебного питания от 3: 1 до 5: 1. Суточная потребность в линолевой кислоте — 6—10 г, ее суммарное содержание в жирах пищевого рациона должно составлять не менее 4 % от общей калорийности.
Для здорового организма соотношение жирных кислот должно быть сбалансированным: 10—20 % полиненасыщенных, 50—60 % мононенасыщенных и 30 % насыщенных. Для людей пожилого возраста и больных сердечно-сосудистыми заболеваниями содержание линолевой кислоты должно составлять 40 % от общего содержания жирных кислот. Соотношение полиненасыщенных и насыщенных кислот 2: 1, соотношение линолевой и линоленовой кислот 10: 1.
11.Гидролазы, биол. роль, п/Кл, представители.
Гидролазы — это ферменты, катализирующие процессы гидролиза (гидролиз эфирных, сложноэфирных, пептидных и гликозильных связей, кислотных ангидридов, связей С—С, С-галоида, Р—N).
Гидролазы подразделяются на эстеразы, карбогидразы, протеазы, амидазы, дезаминазы, фосфорилазы и др.
Эстеразы — ферменты, катализирующие реакции расщепления и синтеза сложных эфиров:
эстеразы
R-CO-O-R1 + Н2О <-------- > R-COOH + R1OH
К ним относятся липазы, танназы, хлорофиллазы, пектинэстера-зы (пектазы), фосфатазы, сульфатазы.
Липазами (КФ 3.1.1.3) называются эстеразы, катализирующие гидролиз и синтез жиров:
СН2-О-СО— R, СН2 —ОН
СН—О—СО—R2 + ЗН2О -липаза--> СН—ОН—R1COOН + R2COOH + R3COOH
СН2-О—СО—R3 CH2—ОН
Танназы — ферменты, катализирующие гидролиз сложного эфира таннина.
Хлорофиллазы — это эстеразы, катализирующие переэтерифи-кацию хлорофилла.
Пектазы катализируют гидролиз эфиров пектина.
Фосфатазы ускоряют расщепление и синтез сложных эфиров, образованных спиртами и фосфорной кислотой. Они подразделяются на фосфатазы неспецифического и специфического действия. Неспецифические фосфатазы катализируют отщепление Н,РО4 от фосфорных эфиров, для них характерен широкий диапазон рН (4,5—9,0). К ним относятся рибонуклеаза и дезоксирибонуклеаза, катализирующие распад рибонуклеиновой и дезокси рибонуклеиновой кислот. Специфические фосфатазы действуют на фосфорные эфиры определенного состава. К ним относится фруктозодифосфатаза, действующая только на фруктозоди-фосфорную кислоту. Сульфатазы катализируют гидролиз и синтез сложных эфиров серной кислоты.
К карбогидразам относятся ферменты, катализирующие гидролиз и синтез гликозидов, олиго- и полисахаридов. Карбогидразы подразделяются на олигазы и полиазы. Полиазы — ферменты, катализирующие гидролиз полисахаридов, а олигазы — гидролиз олигосахаридов.
Олигазы
К олигазам относятся а-глюкозидаза, [3-глюкозидаза, а-галакто-зидаза, (3-галактозидаза, (3-фруктофуранозидаза.
а-Глюкозидаза, или мальтаза — фермент, расщепляющий а-глюкозидную связь в дисахаридах и глюкозидах. Биологическим субстратом для данного фермента являются мальтоза и сахароза. Содержится в тканях растений, плесневых грибах, дрожжах, бактериях, проросшем просяном зерне. Просяной солод применяют как добавку к ячменному солоду при изготовлении мальтозной патоки, так как он богат активной мальтазой.
р-Глюкозидаза — фермент, расщепляющий Р-глюкозидную связь в ди- и полисахаридах, Р-глюкозидах (глюкозиды — амигдалин, арбутин).
а-Галактозидаза — фермент, катализирующий гидролиз а-галакто-зидов, например рафинозы и мелибиозы. Этот фермент содержится в пивных дрожжах и грибном солоде, например в такадиастазе — ферментном препарате, полученном из плесневых грибов.
Р-Галактозидаза (К.Ф 3.2.1.23), или лактаза, — фермент, катализирующий гидролиз лактозы на глюкозу и галактозу; содержится в бактериях, плесневых грибах, плодах миндаля, в лактозных дрожжах, в молочных железах животного организма.
Р-Фруктофуранозидаза (КФ 3.2.1.26), или сахараза, или инвертаза,— фермент, катализирующий расщепление сахарозы на глюкозу и фруктозу.
а-Глюкозидаза гидролизует сахарозу у а-глюкозидного С-атома остатка глюкозы, а Р-фруктофуранозидаза гидролизует связь у Р-глюкозидиого С-атома остатка фруктозы. р-Фруктофуранозидаза (сахараза) также гидролизирует рафинозы (триозы) с образованием молекулы фруктозы и молекулы дйсахарида мелибиозы.
Полиазы
Одной из полиаз является амилаза, которую называют также птиалином, или диастазой. Амилаза была открыта в 1814 г. К.С. Кирхгофом. Содержится в слюне, панкреатическом соке, плесневых грибах, проросшем зерне; гидролизует крахмал до декстринов и мальтозы. Амилазы гидролизуют крахмальные зерна и крахмальный клейстер. Установлено существование трех амилаз: а-амилазы, Р-амилазы и у-амилазы (глюкоамилазы).
а-Амилаза (КФ 3.2.1.1) (другие названия птиалин, декстриноге-ноамилаза, гликогеназа) — содержится в слюне, в проросших зернах пшеницы, ржи, ячменя.
fi-Амилаза (КФ 3.2.1.2.), или сахарогеноамилаза, содержится в зернах пшеницы, ржи, ячменя, соевых бобах.
а- и $-Амилазы различаются по характеру действия на компоненты крахмала — амилозу и амилопектин.
fi-Амилаза расщепляет амилозу на 100 % до мальтозы, амилопектин — на 54 % до мальтозы и на 46 % — до декстринов, дающих с йодом красно-коричневое окрашивание. Данные декстрины гидро-лизуются ос-амилазой до декстринов с меньшей молекулярной массой, не дающих окрашивания с йодом, с образованием незначительного количества мальтозы.
Декстрины, образовавшиеся при действии Р-амилазы на амилопектин, гидролизуются а-амилазой с образованием декстринов, обладающих меньшей молекулярной массой и дающих окрашивание с йодом.
При последующем длительном действии а-амилазы на крахмал 85 % его превращается в мальтозу. Таким образом, при действии на крахмал Р-амилазы образуется в основном мальтоза и незначительное количество высокомолекулярных декстринов-. При действии на крахмал а-амилазы образуются в основном декстрины меньшей молекулярной массы и незначительное количество мальтозы.
Оптимум рН Р-амилазы — 4, а-амилазы — 5,5.
Так как активность а-амилазы снижается при повышении кислотности, тесто из муки, полученной из проросшего зерна, замешивают на жидких дрожжах (молочнокислых заквасках); молочная кислота угнетает действие а-амилазы.
а-Амилаза более устойчива к действию повышенных температур, ее температурный оптимум (68 °С) выше температурного оптимума Р-амилазы (52 °С).
Семена растений отличаются содержанием а- и Р-амилазы. Так, Р-амилаза содержится в непроросших семенах пшеницы, ржи и ячменя, а-амилаза образуется лишь при прорастании. В непроросших и проросших соевых бобах присутствует только Р-амилаза. В непроросших семенах сорго содержится а-амилаза.
Инактиваторы амилазы — белки и дубильные вещества — служат регулирующим фактором в прорастающем и созревающем зерне.
Солод, применяемый при изготовлении пива-и осахаривании картофельных или мучных заторов в спиртовой промышленности, является источником активной амилазы, превращающей крахмал в сбраживаемый сахар — мальтозу. Активный грибной солод получают из плесневых грибов.
Глюкоамилаза (КФ 3.2.1.3) — фермент, гидролизующий крахмал с образованием глюкозы и небольшого количества декстринов. Получают из плесневых грибов и используют для производства кристаллической глюкозы и глюкозной патоки.
Целлюлаза — комплекс двух ферментов: эндоглюканазы (КФ 3.2.1.4) и экзоглюканазы (КФ 3.2.1.74). Гидролизует клетчатку с образованием целлобиозы. Целлюлаза содержится в проросшем зерне, бактериях и плесневых грибах, является активным ферментом в грибах-вредителях, живущих на древесине.
Бактерии, живущие в желудках травоядных животных, выделяют активную целлюлазу, которая гидролизует клетчатку. Этим объясняется способность животных переваривать и усваивать клетчатку.
Инулиназа(КФ 3.2.1.7), или инулаза, — фермент, гидролизующий инулин с образованием фруктозы. Обнаружена в высших растениях содерж ащих большое количество инулина, и плесневых грибах.
Гемицеллюлазы — группа ферментов, гидролизующих различные гемицеллюлозы. Последние содержатся в прорастающих семенах и плесневых грибах. Например, ксиланаза (КФ 3.2.1.32) гидролизует ксиланы до ксилозы.
Протопектиназа и полигалактуроназа (пектиназа) — ферменты, расщепляющие пектиновые вещества. Протопектиназа — фермент, разрушающий связи между метоксилированной полигалактуроновой кислотой и арабаном или галактаном. Эта кислота (растворимый пектин) гидролизуется пектинэстеразой до метилового спирта и полигалактуроновой кислоты. Полигалактуроназа катализирует гидролиз полигалактуроновой кислоты. Полигалактурон'аза характерна для бактерий и плесневых грибов, в высших растениях встречается редко (пока обнаружена только в плодах томатов). Плесневые грибы используются для получения препаратов данных ферментов, которые применяются в пищевой промышленности для осветления фруктовых соков, плодовых и виноградных вин, содержащих большое количество растворимого пектина.
^Протеазы (протеолитические ферменты) — это ферменты, катализирующие гидролиз белков, полипептидов, олигопептидов. Подразделяются на протеиназы (полипептидазы) и пептидазы.
Протеиназы (полипептидазы) осуществляют гидролиз белков и высокомолекулярных полипептидов. Пептидазы расщепляют низкомолекулярные пептиды (тетра-, три- и дипептиды).
По воздействию на конкретные участки пептидной цепи протеоли-тические ферменты делятся на эндопептидазы (действуют на участки цепи, расположенные далеко от ее концов) и экзопептидазы (отщепляют концевые аминокислоты). Примерами экзопептидаз являются кар-бокси- и аминопептидазы.
В зависимости от строения активного центра протеолитических ферментов выделяют следующие протеиназы:
— сериновые, содержащие в активном центре серии (трипсин, химотрипсин);
— тиоловые, содержащие в активном центре цистеин (катепсин В);
— кислые, содержащие в активном центре две —СООН-группы (пепсин, катепсин Д).
Протеолитические ферменты подразделяются на ферменты желудочно-кишечного тракта, тканевые и бактериальные.
Дезамидазы (амидазы) - гидролазы, катализирующие процессы дезаминирования амидов кислот с образованием NH3 и кислоты. К амидазам относятся аргиназа, уреаза, аспарагиназа, глутаминаза. Аргиназа — фермент печени, катализирует гидролиз аргинина с образованием мочевины и орнитина. Уреаза — фермент, катализирующий гидролиз мочевины с образованием NH3 и СО2. Аспарагиназа деза-минирует аспарагин, глутаминаза - глутамин.
Дезаминазы катализируют процессы дезаминирования азотистых оснований (аденин,гуанин) с образованием спиртов и аммиака.
Гуаназа и аденилаза катализируют дезаминирование гуанина и адениловой кислоты.
В растительной клетке гидролитические ферменты локализованы в вакуолях, отделенных от цитоплазмы белково-липидной мембраной —тонопластом.
Пищеварительные ферменты
П'ищеварительные ферменты — это энзимы, катализирующие процессы гидролиза пищевых веществ. К ним относятся протеолити-ческие ферменты.
Пищеварительные протеолитические ферменты
Протеолиз — это гидролиз белков. Протеолитические пищеварительные ферменты {протеазы) — ферменты, катализирующие гидролиз белков. Протеолитические ферменты относятся к классу гидро-лаз. Протеазы подразделяются на протеиназы (полипептидазы) и пептидазы.
Протеиназами (полипептидазами) называются ферменты, катализирующие гидролиз белков и полипептидов, пептидазами — ферменты, катализирующие гидролиз олигопептидов.
Кроме того, протеазы подразделяются на эндопептидазы и эк-зопептидазы. Эндопептидазы — это протеазы, катализирующие разрыв внутри пептидной цепочки, экзопептидазы — ферменты, катализирующие отщепление концевых аминокислот. К эндопептидазам относятся пепсин, трипсин и др., к экзопептидазам — карбоксипепти-даза, аминопептидаза.
К протеолитическим ферментам относятся ферменты желудка (пепсин, парапепсин, гастриксин, химозин) и ферменты кишечника (трипсин, химотрипсин, аминопептидаза, ди-, три-, тетра- и карбокси-пептидаза, эластаза).
Коллаген в организме человека не гидролизуется, так как фермент коллагеназа отсутствует.
Ферменты желудка
Толщина слизистой оболочки желудка от 1,5 до 2,5 мм, она покрыта слоем специальных железистых клеток, которые выделяют сли-зеподобный секрет. В более глубоких слоях слизистой оболочки расположены железы, состоящие из главных и обкладочных клеток. Эти железы вырабатывают желудочный сок, содержащий ферменты и соляную кислоту.
В слизистой желудка образуются биологически активные вещества (гормон гастрин, олигопептиды), оказывающие возбуждающее
действ.ие на нейроны продолговгого мозга, что усиливает активность желудочных желез.
П епсин (от греч. pepsls — пш№арение) — протеиназа, входящая в соста_в желудочного сока, — выкатывается обкладочными клетками ели зистой оболочки желудка,вносится к гидролазам. Молекула пепсин а представляет собой однуголипептидную цепь, содержащую 327 ам инокислотных остатков. Р?псин получают в виде белковых криста ллов. Молекулярная масса!епсина — 34 644. Кристаллический 1 пепсин обладает высокой каталимческой активностью, 1 г пепсина за 2 ч створаживает 100 000 л молка или растворяет 50 кг сваренного яичн ого белка. Активатором пеяина являются ионы водорода (HCI) и сам ггепсин. Профермент пепеш — пепсиноген.
И, пепсин Пепсиноген-------->Пепсин
Пепсин гидролизует не толыо белки, но поли- и олигопептиды (основной субстрат - белок), а танке пептидные связи, образованные аминными группами ароматических аминокислот. Оптимум рН для пепсину 1,5-2,5.
Для определения активности пепсина используется метод Пятницкого (экспресс-метод). В основ(иетода лежит способность пепсина створа>кивать белок молока — ка*иноген. Створаживание молочно-ацетат1 юй смеси пепсином при рН4,9 и температуре 25 °С происходит пропорционально его способнети переваривать белок. За единицу акти вности пепсина принимаюжоличество пепсина (в мг), которое при рЩ 4,9—5,0 и температуре 2S °С створаживает 5 см3 молочно-ацетатчой смеси (данная единица сютветствует 0,010 мг кристаллического пепсина). Желудочный сок в ирме содержит в 1 см:! 40—60 единиц^ пепсину, т. е. в 1 см3 желудочного сока должно быть 0,4-0,6 мг пепсина.-i
Гастриксин (от греч. gastros- желудок) — фермент, входящий в состав желудочного сока, вырайтывается слизистой желудка. Относится к гидролазам, является яротеиназой. Оптимум рН 3,5—4,0. Профермент гастриксина - гастриксиноген. Активатором гастрикси-на являются ионы Н+ (НС1), субстратом — белки, продуктами гидролиза — полипептиды.
Псжрапепсин — фермент, входящий в состав желудочного сока, вырабатывается обкладочными клетками слизистой оболочки желудка. Пар апепсин относится к гидройзам, является протеиназой. Активируется ионами Н+(НС1). Субаратом для парапепсина является белок гемоглобин, продуктами гидролиза — полипептиды.
Желатиназа — гидролаза, присутствующая в желудочном соке, гидролизует полипептид желатину. Является протеиназой.
Химозин (от греч. chymos — сок) - протеиназа, вырабатываемая слизистой желудка. Другие названия фермента — реннин, сычужный фермент, лабфермент. Характерен для детского организма. Активатором являются ионы Нт, зимогеном — химозиноген, субстратом - белки молока. В промышленности химозин получают из сычуга (четвертый отдел желудка теленка), в котором содержится сычужный фермент, створаживающий молоко. Его также применяют в качестве створаживающего средства при изготовлении сыров. Сычужный фермент превращает белок молока казеиноген в сгусток казеината кальция. Очищенный сычужный фермент получают в виде кристаллев, он обладает высокой каталитической активностью: одна часть фермента при рН 6,2 и температуре 37 °С свертывает 4 550 000 частей молока. ■
Ферменты кишечника
Кишечный сок — пищеварительный сок, выделяемый либеркю-новыми железами слизистой оболочки кишечника. За сутки выделяется 2 л кишечного сока.
Кишечный сок — это бесцветная мутноватая жидкость, рН > 7. В состав сока входят следующие протеолитические ферменты: кар-бокси-, амино-, ди-, три-, тетрапептидаза.
Кишечный сок содержит энтерокиназу, которая является активатором всех протеолитических ферментов панкреатического сока.
Панкреатический (поджелудочный) сок — пищеварительный сок поджелудочной железы. За сутки вырабатывается 0,8 л панкреатического сока, который поступает в двенадцатиперстную кишку.
Секреция поджелудочного сока начинается через 2—3 мин после приема пищи и продолжается 6—14 ч, при приеме жирной пищи происходит более продолжительное сокоотделение.
Панкреатический сок является бесцветной прозрачной жидкостью, имеет рН 7,8—8,7. Протеолитическими ферментами панкреатического сока являются трипсин, химотрипсин, карбоксипептидаза.
Трипсин (от греч. thrypsis — разжижение) — протеиназа, которая входит в состав панкреатического сока, выделяемого поджелудочной железой и поступающего по протокам в тонкий кишечник. Молекулярная масса трипсина 24 000. Изоэлектрическая точка соответствует рН 10, оптимум рН 8—9 (физиологический диапазон рН тонкого кишечника 7,8—8,2).
Трипсин гидролизует преимущественно пептидные связи, в которых участвует карбоксильная группа лизина или аргинина. Зимогеном трипсина является трипсиноген. В 1899 г. Шеповальников, сотрудник лаборатории академика И.П. Павлова, установил, что в пищеварительном соке трипсин присутствует в виде профермента трипсиногена. Активация трипсина происходит в двенадцатиперстной кишке. Активаторами трипсина являются трипсин и энтерокиназа. Активированный трипсин в свою очередь является активатором всех протеолитических ферментов в полости двенадцатиперстной кишки. В процессе активации из одной молекулы трипсина отщепляется одна молекула гексапептида.
Химотрипсин (от греч. chymos — сок + thrypsis — разжижение) — пищеварительный протеолитический фермент, входит в состав панкреатического сока. Проферментом химотрипсина является химотрипсиноген, активатором — энтерокиназа и трипсин. Химотрипсин относится к классу гидролаз, является протеиназой. Оптимум рН 7,8—8,2. Субстратами для химотрипсина являются полипептиды, продуктами гидролиза — олиго-пептиды. Химотрипсин расщепляет пептидные связи между ароматическими аминокислотами, а также связи, которые не быди гидролизованы трипсином. Для активного центра химотрипсина характерно наличие остатков таких аминокислот, как серии, гистидин, аспарагиновая кислота. \
Карбоксипептидаза (карбоксиполипептидаза) — пищеварительная гидролаза — вырабатывается поджелудочной железой и входит в состав панкреатического сока. Субстратом для карбоксипептидазы являются олигопептиды, содержащие С-концевые аминокислоты (концев^-е. аминокислоты, содержащие свободную группу -СООН).
Шифр карбоксипептидаз — 3.4.12.
Одним из представителей является карбоксипептидаза А (КФ 3.4.12.2), которая по классификации относится к металлофер-ментам. Молекулярная масса — 35 000, 1 моль содержит 1 моль Zn2+ на 1 моль белка. Содержится в кишечнике, выделена в виде кристаллов. Используется в карбоксипептидазном методе определения аминокислотной последовательности в белковой молекуле.
Аминопептидаза — пищеварительный гидролитический фермент, вырабатываемый слизистой кишечника, входит в состав кишечного сока. Катализирует отщепление N-концевых аминокислот — аминокислот, находящихся на конце полипептидной цепи и содержащих свободную аминогруппу —NH2.
Аминопептидазы имеют шифр 3.4.11.
Одним из представителей является широко распространенная в природе лейцинаминопептидаза (КФ 3.4.11.1). Данный фермент содержит Zn, гидролизует соединения, имеющие N-концевую аминокислоту лейцин (пептиды, амиды).
Тетра-, три- и дипептидазы — ферменты, которые расщепляют тетра-, три- и дипептиды до аминокислот, относятся к пептидазам.
Эрепсин — смесь аминопептидаз и тетра-, три-, дипептидаз — входит в состав кишечного сока.
Энтерокиназа — специфичный активатор трипсиногена и химот-рипсиногена. Синтезируются кишечными эпителиоцитами. С помощью желчных кислот энтерокиназа попадает в просвет кишечника, поэтому активация происходит и в полости и мембранно.
На участке между лизином и изолейцином энтерокиназа строго избирательно отщепляет пептид из шести молекул (гексапептид). Она "узнает" последовательность аминокислотных остатков изолейцин — валин — глицин.






