Для того чтобы синтезировать жирную кислоту, нужно последовательно присоединять к ацетил-СоА двууглеродные единицы. Активным донором таких единиц является малонил-СоА, хотя его малонильный остаток содержит не два, а три углеродных атома. Малонил-СоА образуется из ацетил-СоА в результате присоединения карбоксильной группы. Но прежде чем это произойдет, находящийся в матриксе митохондрий ацетил-СоА должен попасть в цитоплазму, где локализован комплекс синтазы жирных кислот.
Транспорт ацетил-СоА из митохондрий в цитозоль
В матриксе митохондрий основное количество ацетил-СоА образуется при окислительном декарбоксилировании пирувата, в процессе β-окисления жирных кислот, при расщеплении углеродных скелетов аминокислот. Ацетил-СоА является заряженной молекулой, поэтому он не способен преодолеть внутреннюю мембрану митохондрий. Для транспорта ацетильных группт в цитоплазму существует специальный «челночный механизм». Им является цитрат- малат-пируватный транспортер (рис.23.3).

Рис.23.3. Транспорт ацетил-СоА из матрикса митохондрий в цитозоль
С помощью этого «челнока» ацетильные компоненты попадают в цитоплазму в составе цитрата, который при участии АТР-цитрат-лиазы расщепляется на оксалоацетат и ацетил-СоА. Для реакции необходимы АТР и HSCоА. Оксалоацетат восстанавливается в малат и таким образом возвращается в матрикс, где регенерируется в цитрат. Часть малата под действием малик-фермента (NADP+-зависимой малатдегидрогеназы) подвергается окислительному декарбоксилированию с образованием пирувата и NADPH. NADPH используется в качестве восстановительного эквивалента в липогенезе. Пируват транспортируется в митохондрии.
Транспорт цитрата из митохондрий в цитозоль происходит при высокой концентрации кислоты. Это наблюдается тогда, когда изоцитратдегидрогеназа ингибируется высокими концентрациями АТР. При повышении концентрации цитрата в митохондриях начинает работать «челночный механизм» (рис.23.3) − цитрат поступает в цитозоль. Появление его в цитозоле служит аллостерическим сигналом о том, что цикл лимонной кислоты перегружен топливом и что избыток ацетил-СоА должен запасаться в виде триацилглицеролов.
Образование малонил-СоА
Лимитирующей стадией в биосинтезе ЖКявляетсяобразование малонил-СоА из ацетил-СоА и бикарбоната. Реакция карбоксилирования осуществляется в цитозоле, катализируется ацетил-СоА- карбоксилазой и требует затраты одной молекулы АТР. Участвующий в реакции СО2 образует свободную карбоксильную группу малонил-СоА.
Ацетил-СоА-карбоксилаза − сложный фермент, простетической группой которого служит биотин (рис.23.4).

Рис.23.4. Строение ацетил-СоА-карбоксилазы
Образование малонил-СоА происходит в две стадии. На первой стадии биотинкарбоксилаза осуществляет АТР-зависимое присоединение СО2 к атому азота биотина; на второй − активированный СО2 при участии карбоксилтрансферазы переносится с биотина на ацетил-СоА с образованием малонил-СоА (рис.23.4, 23.5).

Рис.23.5. Образование малонил-СоА
Ацетил-СоА-карбоксилаза − регуляторный фермент. Катализируемая этим ферментом реакция является лимитирующей стадией всего процесса биосинтеза ЖК в животных тканях. Ацетил-СоА-карбоксилаза существует в малоактивной протомерной и активной форме (нитевидный полимер). Взаимопревращение этих форм и факторы, влияющие на данный процесс, приведены на рис. 23.6.
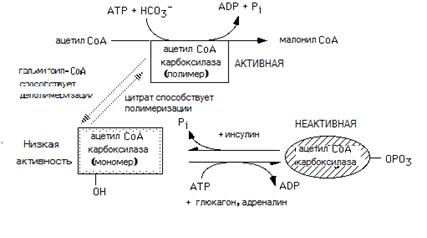
Рис. 23.6. Аллостерическая регуляция и ковалентная модификация ацетил-СоА-карбоксилазы
Положительным аллостерическим эффектором, способствующим образованию полимерной молекулы фермента, служит цитрат, отрицательным ‒ пальмитоил-СоА. Фосфорилирование ацетил-СоА-карбоксилазы, осуществляемое АМР-зависимой протеинкиназой, ингибирует фермент. Поэтому клетка при низкой величине энергетического заряда (много АМР, мало АТР) не синтезирует жирные кислоты. Глюкагон и адреналин ингибируют синтез ЖК, а инсулин − стимулирует (эти гормоны оказывают противоположный эффект на деградацию ЖК).
Экспрессия синтазы жирных кислот регулируется гормонами. Инсулин стимулирует синтез фермента в печени, а полиеновые жирные кислоты уменьшают транскрипцию гена синтазы жирных кислот. В адипоцитах экспрессия гена синтазы жирных кислот ингибируется лептином, играющим важную роль в регуляции приема пищи и метаболизме жирных кислот.






