Свободные жирные кислоты присутствуют в тканях и плазме крови в небольших количествах и в норме не накапливаются, т.к. используются для синтеза различных липидов и в первую очередь триацилглицеролов. Синтез триацилглицеролов происходит из глицерола и жирных кислот (преимущественно стеариновой, пальмитиновой и олеиновой).
Основными предшественниками для синтеза триацилглицеролов служат активированные жирные кислоты и глицерол-3-фосфат. Глицерол-3-фосфат образуется либо при прямом фосфорилировании за счет АТР при участии глицеролкиназы, либо при восстановлении промежуточного продукта гликолиза ‒ дигидроксиацетон-3-фосфата ферментом глицерол-3-фосфатдегидрогеназой (рис.23.11).
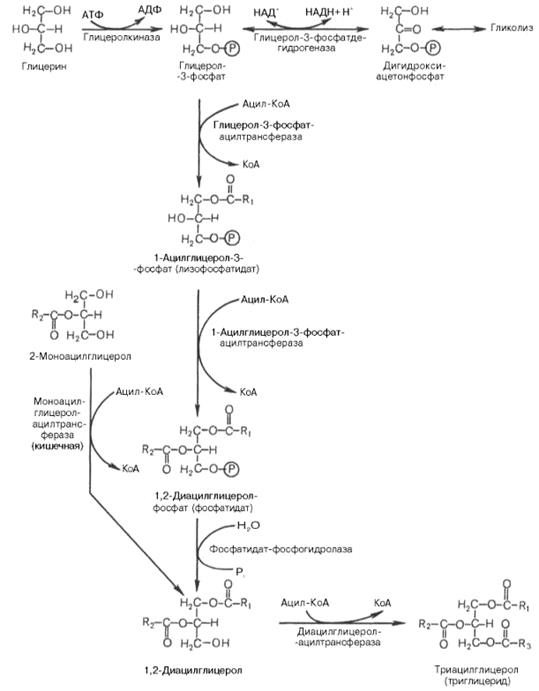
Рис.23.11. Пути биосинтеза триацилглицеролов
В синтезе триацилглицеролов принимают участие ферменты ацилтрансферазами, которые присоединяют ацильные группы от активированных жирных кислот к моноацилглицеролу, либо диацилглицеролу.
Установлено, что большинство ферментов, участвующих в биосинтезе триацилглицеролов, находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерол-3-фосфат-ацилтрансфераза, – в митохондриях.
ЛЕКЦИЯ 24
БИОСИНТЕЗ ХОЛЕСТЕРОЛА И ЖЕЛЧНЫХ КИСЛОТ
Механизм биосинтеза стеролов долгое время оставался неясным, хотя существовали доказательства беспрепятственного синтеза стеролов у большинства органических форм (исключение составляют насекомые). Сложный процесс биосинтеза стеролов, основные этапы которого совпадают у самых разных организмов, был расшифрован с помощью метода меченых атомов.
Чуть меньше чем половина холестерола (ХС) в организме человека образуется при биосинтезе de novo. Биосинтез в печени составляет приблизительно 80%, в тонком кишечнике синтезируется приблизительно 15%, в коже – порядка 5% от количества, продуцируемого ежедневно стерола. Схема синтеза холестерола приведена на рис.24.1. Промежуточные продукты (геранилпирофосфат, фарнезилпирофосфат) могут использоваться для синтеза долихола, коэнзима Q, боковой цепи гема а, а также для посттрансляционной модификации белков (пренилированные белки). Помимо этого, в печени из холестерола образуются желчные кислоты, а в эндокринных железах стероидные гормоны.
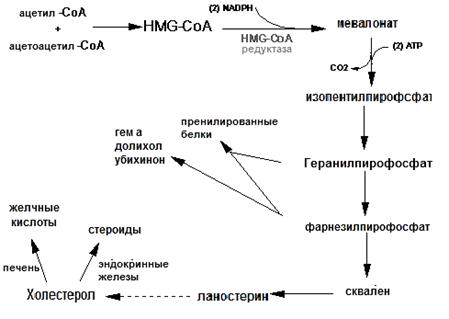
Рис.24.1. Общая схема биосинтеза стеролов
Биосинтез холестерола
Синтез ХС происходит в цитоплазме и микросомах. Исходным веществом для синтеза стеролов является ацетил-СоА, который транспортируется из митохондрий в цитоплазму (транспорт ацетил-СоА рассмотрен ранее, в лекции 23). 3-гидрокси-3-метилглутарил-СоА редуктазная (ГМГ-СоА редуктаза) реакция ‒ первая, практически необратимая реакция в цепи биосинтеза ХС. Она протекает со значительной потерей свободной энергии. Установлено, что данная реакция лимитирует скорость биосинтеза холестерина.
Реакции фосфорилирования требуются для солюбилизации изопреноидных интермедиатов данного пути.
Биосинтез холестерола осуществляется в несколько этапов. I этап (рис.24.2) включает образование 3-гидрокси-3-метилглутарил-СоА (ГМГ-СоА) из ацетил-СоА и превращение ГМГ-СоА в мевалонат. В результате двух последовательно протекающих реакций (тиолазной и гидроксиметил-глутарил-СоА-синтазной) из трех молекул ацетил-СоА образуется одна молекула 3-гидрокси-3-метилглутарил-СоА.
Следующая реакция – превращение ГМГ-СоА в мевалонат. Она катализируется ГМГ-СоА редуктазой. Процесс восстановления требует затраты двух молекул NADPH. Источником NADPH является пентозофосфатный путь окисления глюкозы, а также NADP+-зависимые цитозольные малатдегидрогеназная и изоцитратдегидрогеназная реакции.
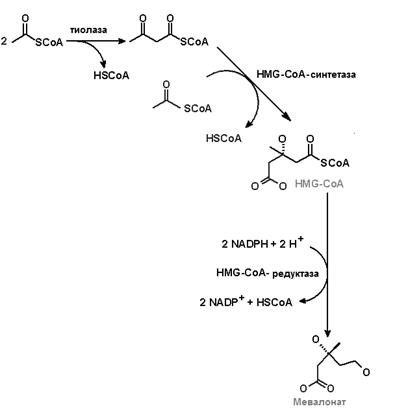
Рис.24.2. Первый этап биосинтеза холестерола
II этап (рис.24.3) – превращение мевалоната в фарнезилпирофосфат. Мевалонат дважды подвергается фосфорилированию по 5-ОН-группе при участии киназ. Донором фосфатных групп в этих реакциях служит АТР. Пирофосфомевалонат подвергается декарбоксилированию и дегидратированию, превращаясь в изопентенилпирофосфат (ИПФ, С5). Изопентенилпирофосфат ‒ активная изопреноидная единица, широко распространенная в природе и участвующая не только в синтезе ХС, но в смниезе каротиноидов, боковых цепей убихинонов, витаминов К и Е.
ИПФ изомеризуется в диметилаллилпирофосфат (ДПФ, С5). Взаимодействие ИПФ с молекулой диметилаллилпирофосфата, катализируемое изопентенилтрансферазой, приводит к образованию геранилпирофосфата (С10). Изопентенилтрансфераза осуществляет перенос диметилаллильного радикала на раскрывающуюся двойную связь в молекуле ИПФ. При этом происходит миграция двойной связи и потеря одной молекулы пирофосфата.
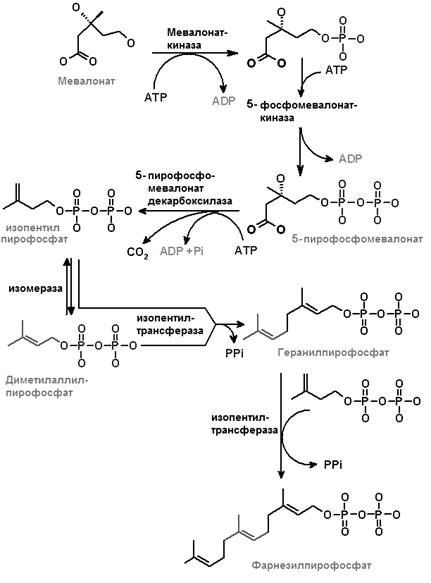
Рис. 24.3. Превращение мевалоната в фарнезилпирофосфат
К геранилпирофосфату вновь присоединяется ИПФ, в результате образуется фарнезилпирофосфат (С15) и освобождается пирофосфат, получающий атом водорода от близлежащей метиленовой группы. Эта конденсация является NADPН-зависимым процессом.
Этот же фермент катализирует реакцию переноса радикала геранила от геранилпирофосфата к следующей молекуле ИПФ. Освобождающийся в этой и в предыдущей реакции пирофосфат гидролизуется неорганической пирофосфатазой, что обеспечивает необратимость биосинтетического процесса. Продуктом данного этапа биосинтеза холестерола служит фарнезилпирофосфат (С15).
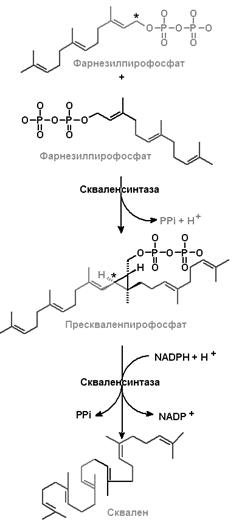
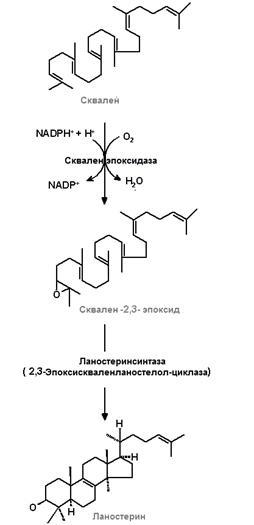
III этап (рис.24.4, рис. 24.5) ‒ образование сквалена из фарнезилпирофосфата и превращение сквалена в ланостерол.
| 
|
| Рис.24.4. Образование сквалена | Рис.24.5.Превращение сквалена в ланостерол |
Две молекулы фарнезилпирофосфата, соединяясь «голова к голове» и теряя каждая свой пирофосфат, образуют сквален, содержащий 30 втомов углерода. Сквален образуется из прескваленпирофосфата под действием фермента скваленсинтазы, локализованной в эндоплазматическом ретикулуме. Источником атомов водорода в этой реакции является NADPH.
Сквален ‒ непредельный углеводород, состоящий их шести изопреноидных единиц (С30). Молекула сквалена легко принимает пространственную конфигурацию, близкую к пространственной конфигурации стеролов.
На стадии образования сквалена завершается анаэробная фаза биосинтеза ХС. Последующая фаза биосинтеза ХС является аэробной. На первом этапе при участии сквален-эпоксидазы, являющейся монооксигеназой, сквален легко окисляется с образованием сквален-2,3-эпоксида.
Ланостерол-синтаза осуществляет замыкание шести ‒ и пятичленных циклов в результате протонирования эпоксидной группы и смещения электронной плотности в системе двойных связей сквалена. По такому пути протекает образование ланостерола в клетках печени. У растений и других организмов в циклизации сквален-2,3-эпоксида принимают участие другие циклизующие ферментные системы с образованием продуктов иных, нежели ланостерол. Ланостерол уже имеет гидроксильную группу в положении 3 и три лишние по сравнению с ХС метильные группы. Они окисляются до карбоксильных, которые затем удаляются декарбоксилированием.
IV этап (рис.24.6) – превращение ланостерола в холестерол. Преобразование ланостерола ‒ многоступенчатый процесс, в ходе которого образуются разнообразные индивидуальные стеролы (зимостерол, десмостерол), характерные для животного и растительного мира.
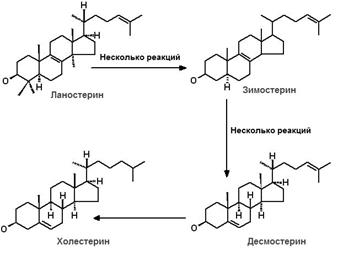
Рис.24.6. Трансформация ланостерола в холестерол
Хотя ланостерол и похож по структуре на холестерол, для его превращения в ХС требуется 20 дополнительных реакций. Ферменты, ответственные за эту трансформацию, локализованы в ЭПР. Преобразование ланостерола в ХС может идти двумя путями. Один из них ‒ восстановление десмостерола (приведен на рис. 24.6). Другой путь включает образование 7-дегидролхолестерола как предпоследнего интермедиата при синтезе холестерина.
Независимо от заключительного пути преобразования ланостерола, суммарный итог всех реакций биосинтеза ХС выглядит следующим образом:
18 СН3СОSСоА + 10 Н+ + ½ О2→ С27Н46О + 9СО2 + 18 HSСоА
Источником углеродного скелета холестерола служит ацетил-СоА, донором водорода являются вода и NADPН. Начиная со сквалена и заканчивая холестеролом, все промежуточные продукты биосинтеза нерастворимы в водной среде. Поэтому они участвуют в конечных реакциях биосинтеза ХС, будучи связанными со стеринпереносящими белками. Это обеспечивает их растворимость в цитозоле клетки и протекание соответствующих реакций. Стеринпереносящие белки обеспечивают также перемещение ХС внутри клетки, что имеет важное значение для вхождения его в клеточные мембраны, окисления в желчные кислоты, превращения в стероидные гормоны.
Эфиры холестерола ‒ принципиальная форма циркулирующего ХС ‒ образуются на цитоплазматической стороне ЭПР.
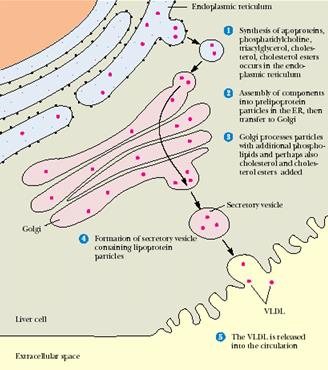
Рис. 24.7. Синтез ХС и его эфиров в эндоплазматическом ретикулуме
Биосинтез стеридов протекает путем переноса остатка высшей жирной кислоты от молекулы ацил-СоА на место водорода ОН-группы стерола. Катализирует этот процесс холестерол-ацилтрансфераза. Источником ацильных групп при биосинтезе стеридов могут выступать глицерофосфолипиды, в частности фосфатидилхолин. Он участвует в образовании эфиров холестерола лимфы и плазмы крови у человека при участии фосфатидилхолин-холестерол-ацилтрансферазы.
Регуляция биосинтеза ХС
Скорость синтеза ХС регулируется по принципу отрицательной обратной связи. Основной пункт регуляции ‒ синтез мевалоновой кислоты ГМГ-СоА редуктазой. Холестерол подавляет ее синтез. При содержании 2-3 г холестерола в суточной пище человека синтез собственного ХС почти полностью прекращается.
Предполагается, что ХС или продукты его окисления в клетке могут угнетать непосредственно синтез редуктазы или индуцировать синтез ферментов, участвующих в ее деградации. При этом тормозится восстановление ГМГ-СоА в мевалоновую кислоту и синтез ХС в целом.
Скорость синтеза ГМГ-СоА редуктазы в печени подвергается четким суточным колебаниям. Максимум ее приходится на полночь, минимум ‒ на утренние часы. Активность ГМГ-СоА редуктазы возрастает при введении инсулина и тиреоидных гормонов. Угнетение активности фермента наблюдается при голодании, введении глюкагона и глюкокортикоидов.
Биосинтез желчных кислот
Желчные кислоты синтезируются в печени из холестерола. Синтез желчных кислот является доминирующим механизмом для удаления избытка холестерина. Сначала синтезируется из ХС холевая кислота; затем она подвергается АТР-зависимому активированию, превращаясь в холил-СоА (рис.24.8). Далее холил-СоА взаимодействует с таурином и глицином, образуя таурохолевую и гликохолевую кислоту.
Стадией, лимитирующей скорость образования желчных кислот, является реакция, катализируемая 7α-гидроксилазой. Холестерол в этой реакции требует участия электрон-транспортной системы, включающей цитохром Р-450 и NADPH-цитохром Р-450-редуктазу. Регулирующим фактором является концентрация желчных кислот, циркулирующих с желчью: чем выше их концентрация, тем ниже активность 7α-гидроксилазы, и наоборот.
Роль 7α-гидроксилазной реакции в образовании желчных кислот по значению сопоставима с ГМГ-СоА-редуктазной реакцией в биосинтезе холестерола.
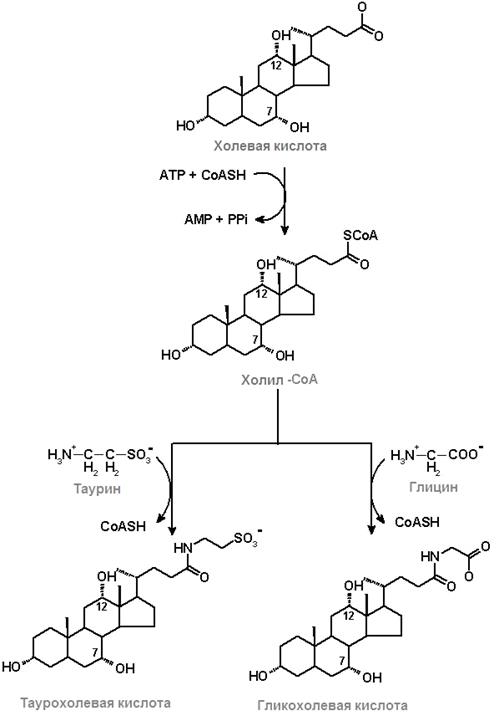
Рис.24.8. Образование таурохолевой и гликохолевой желчных кислот
Доказано, что активность этих ферментов изменяется параллельно, и т.к. как большая часть синтезируемого в печени холестерола (до 75%) идет на образование желчных кислот, часто бывает трудно определить, связано ли угнетение их образования с подавлением ГМГ-СоА-редуктазы или 7α-гидроксилазы.
ЛЕКЦИЯ 25
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ






