В желчном пузыре из желчных кислот, фосфолипидов и холестерола образуются простые мицеллы (соотношение компонентов 12,5:2,5:1). Простые мицеллы выделяются в просвет 12-перстной кишки, где и взаимодействуют с 2-МАГ, α- и β-ДАГ, ХС и ЖК, образуя смешанные (сложные) мицеллы. В гидрофобное ядро смешанной мицеллы входят ЖК, ХС, β-МАГ и α- и β-ДАГ, снаружи располагаются фосфолипиды, лизофосфолипиды и желчные кислоты (рис.21.5). Смешанная мицелла в 100 раз меньше эмульгированной капли жира, поэтому проходит через стенку кишечного эпителия либо путем мицеллярной диффузии, либо – пиноцитоза. Вместе с продуктами гидролиза липидов всасываются жирорастворимые витамины А, D, Е, К и соли желчных кислот.
В эпителиальных клетках ворсинок кишечника сложные мицеллы распадаются на желчные кислоты и продукты гидролиза липидов. Желчные кислоты всасываются в кровь и через портальную вену попадают в печень, затем в желчный пузырь, откуда они снрва секретируются в кишечник в виде простых мицелл. Этот процесс, называемый энтерогепатической циркуляцией, обеспечивает многократное использование желчных кислот. В организме 3-5 г желчных кислот за сутки совершает 5-10 оборотов, обеспечивая всасывание 80-100 г жиров (через 10 дней пул желчных кислот обновляется).

Рис. 21.5. Строение смешанной мицеллы
Смешанные мицеллы построены таким образом, что гидрофобные части молекулы обращены внутрь мицеллы, а гидрофильные – наружу. Гидрофильная оболочка состоит из желчных кислот и фосфолипидов, поэтому мицеллы хорошо растворимы в водной фазе содержимого тонкой кишки. Мицеллы стабильны, они сближаются со щеточной каемкой клеток слизистой оболочки тонкого кишечника и липидные компоненты мицеллы диффундируют через мембраны внутрь клеток.
В эпителиальных клетках слизистой тонкого кишечника происходит ресинтез триацилглицеролов, характерных для того или иного организма и существенно отличающихся по своему строению от пищевого жира. Это обусловлено вовлечением в синтез триацилглицеролов жирных кисло не только экзогенного, но и эндогенного происхождения. Жирные кислоты с короткой углеродной цепью (менее 10 атомов углерода) и глицерол хорошо растворимы в воде и поэтому свободно всасываются в кровь воротной вены, оттуда – в печень, минуя какие-либо превращения в кишечной стенке. В энтероцитах, наряду с ресинтезом триацилглицеролов, происходит также ресинтез и фосфолипидов.
Процесс катаболизма тканевых липидов осуществляется в основном в жировой ткани при участии ацилглицероллипаз. В жировой ткани имеются три фермента, три-, ди- и моноацилглицероллипазаы, участвующие в поэтапном расщеплении жиров. Высвободившиеся жирные кислоты поступают в кровь, где связываются сывороточным альбумином и транспортируются к различным органам.
Активность липаз регулируется ковалентной модификацией по типу фосфорилирование-дефосфорилирование. На рис.21.6 приведен пример гормональной регуляции активности триацилглицероллипазы и диацилглицероллипазы сАМР-зависимой протеинкиназой А в адипоцитах.

Рис.21.6. Гормон-индуцируемый гидролиз триацилглицеролов в адипоцитах
Транспорт липидов
Транспортными формами липидов являются липопротеины – сферические частицы с гидрофильной оболочкой, образованной фосфолипидным монослоем, апобелками, свободным холестеролом, и гидрофобным ядром, состоящим из эфиров холестерола и триацилглицеролов. Известны четыре основных класса липопротеинов крови: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП) и множество промежуточных форм липопротеинов.
ХМ образуются в энтероцитах из ресинтезированных липидов экзогенного происхождения. Они сначала проникают в лимфатическую систему, затем в общий кровоток, где на уровне капилляров различных тканей подвергаются катаболизму под действием липолитического фермента – липопротеинлипазы. Этот фермент активируется при наличии в крови гепарина и при контакте с апобелком, находящемся на оболочке ХМ. Продукты гидролиза – свободные жирные кислоты и глицерол переходят в ткани, где либо окисляются, либо вновь подвергаются эстерификации. В цитозоле клеток многих тканей обнаружен белок, связывающий жирные кислоты, получивший название Z-белка. Считают, что подобно сывороточному альбумину, осуществляющему внеклеточный транспорт длинноцепочечных жирных кислот, Z-белок обеспечивает их внутриклеточный транспорт.
Хиломикроны, обедненные ТАГ в результате катаболизма, превращаются в остаточные (ремнантные) формы, которые утилизируются печенью. Таким образом, хиломикроны снабжают ткани жирными кислотами. Максимальная концентрация ХМ в плазме крови отмечается в абсорбтивную фазу после приема жирной пищи, через 4-6 ч они практически исчезают из крови. В крови, взятой натощак, ХМ в норме почти нет.
ЛПОНП в небольшом количестве образуются в энтероцитах тонкого кишечника и поступают в кровь. Основным местом их образования является печень. ЛПОНП транспортируют, в основном эндогенные ТАГ и ХС из печени. Катаболизм их осуществляется в крови под действием тех же липолитических ферментов, которые гидролизуют ТАГ в составе ХМ, в результате чего ЛПОНП теряют большую часть ТАГ. В крови ЛПОНП интенсивно обмениваются, забирая у зрелых ЛПВП часть холестерола, теряя ТАГ, апобелки Е и С. Метаболизм ЛПОНП в крови приводит к трансформации их в ЛПНП.
ЛПНП – основные холестеролпереносящие липопротеины, ‒ образуются в крови, в основном из ЛПОНП. Транспортируются кровью к тем внепеченочным тканям, на поверхности которых имеется большое количество белков-рецепторов ЛПНП (надпочечники, половые железы, селезенка, кожа и др.).
Апобелок В100, находящийся в оболочке ЛПНП, контактирует с белком-рецептором ЛПНП, в результате чего ЛПНП затягивается в окаймленную ямку, образованную мембранным белком клатрином, которая далее трансформируется в окаймленную везикулу, затем – в эндосому, сливающуюся с лизосомой. Ферменты лизосомы гидролизуют содержимое ЛПНП: апобелок до аминокислот, ТАГ, ФЛ и ЭХС – на составляющие их компоненты.
Метаболизм глицерола
Глицерол, образующийся при гидролизе ТАГ и глицерофосфолипидов, – хороший энергетический субстрат и используется в этих целях практически всеми органами и тканями. В отличие от ЖК, глицерол водорастворим. Независимо от того, вступает ли он на ресинтез жиров или будет подвергаться дальнейшему расщеплению, глицерол, прежде всего, фосфорилируется. Донором фосфатных групп служит АТР. Реакция фосфорилирования катализируется глицеролкиназой.
ЛЕКЦИЯ 22
КАТАБОЛИЗМ ЖИРНЫХ КИСЛОТ
Свободные жирные кислоты образуются при расщеплении экзогенных и эндогенных липидов. Последние чаще всего представлены триацилглицеролами, которые откладываются в клетках в качестве резервного источника энергии и углерода. Кроме того, клетки используют и полярные липиды мембран, метаболическое обновление которых происходит постоянно. Свободные жирные кислоты, образующиеся в процессе липолиза, могут реутилизироваться в ходе анаболических процессов или подвергаться дальнейшему расщеплению. Большинство аэробных клеток способны к полному окислению жирных кислот до углекислого газа и воды.
Катаболизм жирных кислот в живых организмах протекает в три стадии: 1) β-окисление ‒ специфический путь окисления свободных жирных кислот, заканчивающийся образованием ацетил-СоА; 2) цикл лимонной кислоты, в котором осуществляется расщепление ацетильных остатков, образовавшихся при β-окислении ЖК; 3) окислительное фосфорилирование в дыхательной цепи с образованием АТР за счет энергии NADH и FADН2 (рис.22.1).
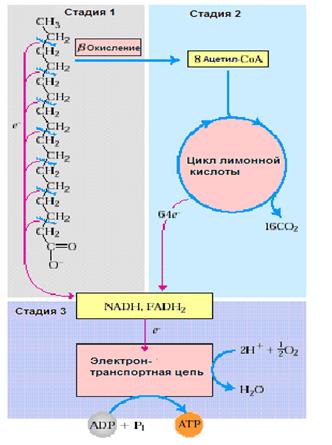
Рис.22.1. Три этапа β-окисления пальмитиновой кислоты
В начале 20 века Ф. Кнооп установил, что процесс расщепления жирных кислот происходит путем последовательного отщепления двууглеродных фрагментов (СН3СОО‒), начиная с карбоксильного конца молекулы.
Ф. Кнооп назвал этот процесс β-окислением, чтобы подчеркнуть, что каждый раз перед расщеплением связи Сα-Сβ происходит окисление β-углеродного атома. Химизм этого процесса с детальным описанием отдельных стадий и ферментов был изучен спустя примерно 50 лет после открытия Ф. Кноопа в работах А. Ленинджера, Ф. Линена, Ю. Кеннеди.
β-окисление ‒ основной путь катаболизма жирных кислот, менее значимым является α-окисление и ω-окисление. Прежде чем вступить на путь окисления, жирная кислота должна быть активирована.
Активация жирной кислоты
Свободные ЖК превращаются в тиоэфиры коэнзима А (НSCoA) – активированную, высокоэнергетическую форму. В процессе активации принимает участие ацил-СоА-синтетаза, использующая молекулу АТР для образования продукта реакции с макроэргической ацилтиоэфирной связью. Известно три типа ацил-СоА-синтатез, характеризующихся различной субстратной специфичностью. Одна из них проявляет высокую специфичность в отношении ацетата (двууглеродного соединения ‒ С2), другая ‒ к жирным кислотам со средней длиной цепи (С4-С12), третья специфична к жирным кислотам с большой длиной цепи (С14-С22). Два последних фермента участвуют в катаболизме как насыщенных, так и ненасыщенных жирных кислот. У прокариот ацил-СоА-синтетазы являются отдельными ферментами, присоединенными к плазматической мембране. У эукариот эти ферменты находятся во внешней мембране митохондрий.
Активация жирной кислоты является двустадийным процессом. На первой стадии происходит взаимодействие жирной кислоты с молекулой АТР, при этом образуется промежуточный ациладенилатный комплекс.
Mg2+
RCH2COO- + ATP → RCH2C О ~ AMP + PPi
Ациладенилат остается связанным с ферментом, а пирофосфат под действием неорганической пирофосфатазы расщепляется на две молекулы ортофосфата.
неорганическая
пирофосфатаза
Н4Р2О7 + Н2О → 2 Н3РО4
На второй стадии ациладенилатный комплекс взаимодействует с HSCoA, в результате образуется тиоэфир жирной кислоты, вторым продуктом реакции является АМР.
Mg2+
RCH2CО ~ AMP + HSCoA → RCH2CО ~SCoA + AMP
Суммарная реакция:
Mg2+
RCH2COO- + ATP + HSCoA + Н2О → RCH2CО ~SCoA + AMP + 2Pi + Н+
∆G 0´= ‒15 кДж/моль (для двухстадийного процесса).
Дальнейшее расщепление СоА-производных жирных кислот осуществляется в матриксе митохондрий. Молекулы ацил-СоА способны проникать через внешнюю митохондриальную мембрану, но внутренняя мембрана является для них непреодолимым барьером. Существует специальный механизм, благодаря которому ацил-СоА преодолевают и внутреннюю митохондриальную мембрану.






