Под третичной структурой понимают пространственное расположение полипептидной цепи (способ укладки цепи в определенном объеме). В стабилизации пространственной структуры основную роль играют нековалентные связи. К ним относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот (гидрофобные взаимодействия), диполь-дипольные взаимодействия. Кроме того, важную роль в формировании третичной структуры играют дисульфидные связи (S-S-мостики) (рис.6.4).
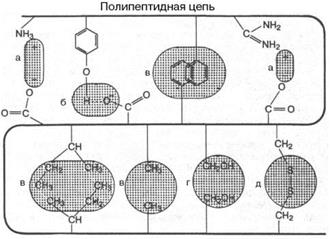
Рис.6.4. Связи, стабилизирующие третичную структуру белка: а) электростатические силы; б) водородная связь; в) гидрофобное взаимодействие; г) диполь-дипольные взаимодействия; д) дисульфидная связь
Дисульфидные связи образуются при окислении сближенных в пространственной структуре белка остатков цистеина в остатки цистина. Считают, что дисульфидные связи, часто множественные, особенно важны для стабилизации маленьких белков, в которых не может возникнуть обширной системы нековалентных взаимодействий.
Третичная структура – уникальное для каждого белка расположение в пространстве полипептидной цепи, зависящее от количества и чередования аминокислот, т.е. предопределенное первичной структурой белка. Конфигурация белковых молекул может быть фибриллярной и глобулярной. Третичная структура многих белков составляется из нескольких компактных глобул, называемых доменами. Между собой домены обычно бывают связаны тонкими перемычками ‒ вытянутыми аморфными полипептидными цепями (рис.6.5).
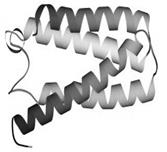

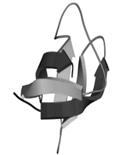

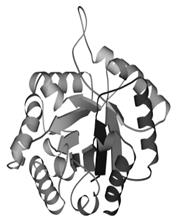
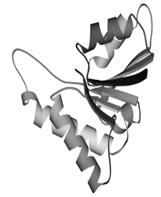

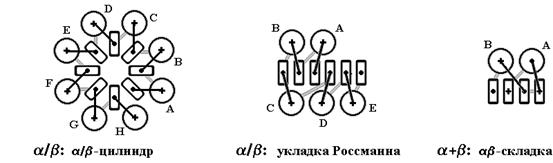
Рис.6.5. Характерные мотивы укладки белковой цепи
Кроме того, в белках встречаются мотивы укладки полипептидной цепи, похожие на орнаменты на индейских и греческих вазах: мотив меандра, мотив греческого ключа, мотив зигзага-"молнии" (рис. 6.6).
При свертывании белковой глобулы значительная часть (не менее половины) гидрофобных радикалов аминокислотных остатков оказывается скрытой от контакта с окружающей белок водой. Происходит образование своеобразных внутримолекулярных «гидрофобных ядер». В них особенно представлены объемные остатки лейцина, изолейцина, фенилаланина, валина.

Рис.6.6. Мотивы укладки белковой цепи и орнаменты на индейских и греческих вазах. Вверху: мотив меандра; в середине: мотив греческого ключа; внизу: мотив зигзага-"молнии"
С появлением третичной структуры у белка появляются новые свойства – биологические. В частности, проявление каталитических свойств связано с наличием у белка третичной структуры. И наоборот, нагревание белков, приводящее к разрушению третичной структуры (денатурация), приводит и к утрате биологических свойств.






