Молекулярной массы белков. Необходимость применения комплекса
Методов для точной оценки молекулярной массы белков
Белки относятся к высокомолекулярным соединениям, в состав которых входят сотни и даже тысячи аминокислотных остатков, объединенных в макромолекулярную структуру. Молекулярная масса белков колеблется от 6000 (нижний предел) до 1000000 и выше в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. Такие полипептидные цепи называются субъединицами. Их молекулярная масса варьирует в широких пределах: от 6000 до 100000 и более. Для выражения молекулярной массы белков используют также специальную единицу – дальтон.
Дальтон (Да) – единица массы, практически равная массе атома водорода (т.е. 1,0000 по шкале атомных масс). Терминами «дальтон» и «молекулярная масса» пользуются как взаимозаменяемыми: например, белок в 20000 дальтон имеет молекулярную массу 20000. Наименование дано в честь Джона Дальтона, разработавшего атомарную теорию строения материи. Килодальтон (кДа) – единица массы, равная 1000 дальтон. Масса большинства белков лежит в пределах от 10 до 100 кДа.
Аминокислотный состав и последовательность аминокислот выяснены для многих тысяч белков. В связи с этим стало возможным вычисление их молекулярной массы химическим путем с высокой точностью. Однако для огромного количества встречающихся в природе белков химическое строение не выяснено, поэтому основными методами определения молекулярной массы все еще остаются физико-химические методы (гравиметрические, осмометрические, вискозиметрические, электрофоретические, оптические и др.). На практике чаще всего используются методы седиментационного анализа, гель-хроматография и гель-электрофорез.
При определении молекулярной массы белков методами седиментационного анализа используют аналитические ультрацентрифуги (первая ультрацентрифуга была сконструирована в 1923 г. Т. Сведбергом), в которых удается создать центробежные ускорения (g), в 200000 и более раз превышающие ускорение земного притяжения. Обычно молекулярную массу вычисляют по скорости седиментации молекул белка или седиментационному равновесию. По мере перемещения молекул от центра к периферии образуется резкая граница «растворитель-белок» (регистрируется автоматически). Оптические свойства растворителя и белка используются при определении скорости седиментации; которую выражают через константу седиментации s, зависящую как от массы, так и от формы белковой частицы:
V
S = ------,
R
где v – скорость перемещения границы растворитель-белок, см/с; ω – угловая скорость ротора, рад/с; r – расстояние от центра ротора до середины ячейки с раствором белка, см. Константа седиментации имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1·10–13 с, условно принята за единицу и названа сведбергом (S). Значения констант седиментации большинства белков лежат в пределах 1–50 S, хотя в ряде случаев эти значения превышают 100 S.
Для вычисления молекулярной массы, помимо константы седиментации, необходимы дополнительные сведения о плотности растворителя и белка и другие согласно уравнению Сведберга:
RTS
M = ------------
D (1- v ρ)
где R – газовая постоянная, эрг/(моль∙гр.); Т – абсолютная температура (по шкале Кельвина); S – константа седиментации; ρ – плотность растворителя; v – парциальный удельный объем молекулы белка; D ‒ коэффициент диффузии.
Определение молекулярной массы белков методом ультрацентрифугирования требует много времени и дорогостоящей аппаратуры. Поэтому в последние годы разработаны простые методы (гель-хроматография и электрофорез).
Гель-хроматографию проводят при заполнении колонки пористым гелем сефадекса. Через колонку пропускают ряд белков с известной молекулярной массой и строят график зависимости логарифма молекулярной массы от значений их элюционных объемов. Между логарифмом молекулярной массы белка, имеющего сферическую форму, и элюционным объемом существует прямая зависимость. Легко определить молекулярную массу исследуемого белка, зная его объем элюции.
Второй разновидностью этого метода является тонкослойная гель-хроматография. Длина пробега белка через тонкий слой сефадекса находится в логарифмической зависимости от его молекулярной массы (рис.7.1).
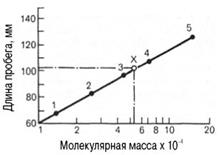
Рис.7.1. Зависимость между длиной пробега белковых частиц при гель-хроматографии в тонком слое сефадекса G-150 и их молекулярными массами
При использовании диск-электрофореза в полиакриламидном геле строят график зависимости между логарифмом молекулярной массы калибровочных белков и подвижностью белковых частиц в полиакриламидном геле, а затем, определив подвижность исследуемого белка, по графику находят его массу (рис.7.2).

Рис.7.2. Зависимость между молекулярной массой и относительной подвижностью белка при диск-электрофорезе в полиакриламидном геле. присутствии додецилсульфата натрия
Электрофорез проводят в присутствии детергента – додецилсульфата натрия (SDS), т.к. только в этом случае наблюдается прямая пропорциональная зависимость между логарифмом молекулярной массы и подвижностью белков.

Додецилсульфат натрия
Денатурация белков
Природные белки имеют определенную, строго заданную пространственную конфигурацию и характерные физико-химические и биологические свойства при физиологических значениях температуры и рН среды. Под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства, т.е. денатурируют. Денатурация ‒ нарушение уникальной структуры нативной молекулы белка, ее третичной структуры, приводящее к потере характерных свойств (растворимость, электрофоретическая подвижность, биологическая активность и т.д.) (рис.7.3). Большинство белков денатурирует уже при нагревании их растворов выше 50–60°С.
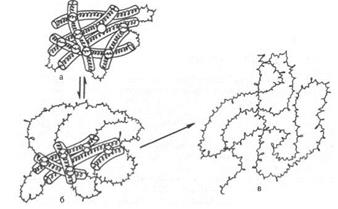
Рис.7.3. Денатурация белка: а) нативный белок; б) стадия обратимой денатурации; в) стадия необратимой денатурации
При денатурации происходит потеря растворимости белка, особенно в изоэлектрической точке, повышение вязкости белковых растворов, увеличение количества свободных функциональных SH-групп и изменение характера рассеивания рентгеновских лучей. Характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка разрушаются в основном нековалентные связи (в частности, гидрофобные взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Денатурация белков с потерей биологической активности может происходить под действием высокой температуры, ультрафиолетового излучения, кислот, щелочей, ионов тяжелых металлов. Денатурация бывает обратимой (ренатурация) и необратимой.
ЛЕКЦИЯ 8






