Поскольку аминокислоты имеют в своем составе как кислотную, так и основную группы, они способны реагировать и с кислотами, и с основаниями. Аминокислоты являются амфотерными органическими соединениями. В определенных условиях (например, при воздействии определенных ферментов) аминокислоты способны реагировать друг с другом. Связь, которой соединены остатки аминокислот, называется пептидной, а соединение, состоящее из двух остатков аминокислот, – дипептидом. Трипептиды, тетрапептиды и т.д. – полипептиды.

Дипептид
Как уже отмечалось, аминокислоты являются амфотерными соединениями, т.к. как содержат и кислотный (-COOH), и основной (-NH2) центры. Следовательно, в нейтральной и близкой к ней среде они существуют в виде внутренних солей (биполярных ионов, или цвиттер-ионов).

Кроме того, некоторые аминокислоты содержат в радикале дополнительные функциональные группы, способные к ионизации.
Основные аминокислоты в водном растворе дают щелочную реакцию и несут положительный заряд:

Кислые аминокислоты в водном растворе проявляют кислотные свойства и обладают отрицательным зарядом:

На диссоциацию аминокислот оказывает влияние pH среды. В очень кислых растворах группа -NH2 протонирована полностью, а COOH-группа практически не ионизирована. В сильно щелочных растворах ‒ наоборот: при значениях pH от 4 до 9 каждая из диссоциирующих групп находится в равновесии со своей неионизированной формой, а обе группы вместе находятся в равновесии с биполярным ионом:

| Катионная форма | Биполярный ион (амфиион) | Анионная форма |
| сильно кислая среда (рН < 5) | 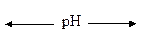
| сильно щелочная среда (рН > 9) |
Амфотерные свойства аминокислот проявляются и в их способности образовывать соли, реагируя как с кислотами, так и с основаниями:

Ещеодним проявлением амфотерности является способность аминокислот образовывать окрашенные растворимые комплексные соединения с Cu2+:
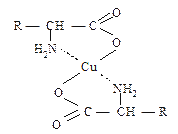
Если сумма зарядов на аминокислоте равна нулю, то значение рН носит название изоэлектрической точки (pI).
При нагревании в сухом виде различные аминокислоты ведут себя по разному. Так, α-аминокислоты образуют циклические дипептиды ‒ дикетопиразины:

В отличие от них, β-аминокислоты претерпевают дезаминирование:
СН3-СН2-СН(NH2)-CH2-COOH → СН3-СН=СН-CH2-COOH + NH3
γ-аминокислоты превращаются в циклические внутримолекулярные пептиды ‒ лактамы:
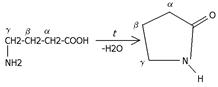
Аминокислоты хорошо растворимы в воде, малорастворимы в органических растворителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокую температуру плавления. Эти свойства указывают на взаимодействие аминных и кислотных групп, вследствие чего аминокислоты в твёрдом состоянии и в растворе (в широком интервале рН) находятся в цвиттер-ионной форме. Взаимное влияние групп особенно ярко проявляется у α-аминокислот, где обе группы находятся в непосредственной близости.






