Аминокислоты
Все аминокислоты отличаются характером радикала, который может быть ациклическим или циклическим. В состав радикала может дополнительно входить вторая карбоксильная группа (такие аминокислоты называются моноаминодикарбоновые) или две аминных группы (диаминомонокарбоновые). В составе отдельных аминокислот могут находиться гидроксильные (серин, треонин), сульфгидрильная (цистеин) и метильная (метионин) группы.
Большинство аминокислот, участвующих в обменных процессах и входящих в состав белков, могут поступать с пищей или синтезироваться в организме в процессе обмена (из других аминокислот, поступающих в избытке). Они называются заменимыми. Некоторые аминокислоты не могут синтезироваться в организме и должны поступать с пищей – это незаменимые аминокислоты. Таких аминокислот девять (гистидин, триптофан, фенилаланин, лизин, метионин, треонин, изолейцин, лейцин, валин).
Практически все белки построены из двадцати α-аминокислот, принадлежащих (за исключением глицина) к L-ряду (табл.5.1).
Таблица 5.1.
Протеиногенные аминокислоты
| Название | Структура (R-CH(NH2)-COOH) | 3-х букв. межд. обозн. | 3-х букв. межд.обозн. | 1-букв. межд. обозн. | ** |
| Глицин | NH2-CH2-COOH | Гли | Gly | G | |
| Аланин | CH3- CH(NH2)-COOH | Ала | Ala | A | |
| Валин | (CH3)2CH- CH(NH2)-COOH | Вал | Val | V | Н |
| Лейцин | CH3-CH(CH3)-CH2- CH(NH2)-COOH | Лей | Leu | L | Н |
| Изолейцин | CH3-CH2-CH(CH3)- CH(NH2)-COOH | Иле | Ile | I | Н |
| Серин | HO-CH2- CH(NH2)-COOH | Сер | Ser | S | |
| Треонин | CH3-CH(OH)- CH(NH2)-COOH | Тре | Thr | Т | Н |
| Цистеин | HS-CH2- CH(NH2)-COOH | Цис | Cys | С | |
| Метионин | CH3-S-(CH2)2- CH(NH2)-COOH | Мет | Met | М | Н |
| Лизин | NH2-(CH2)4- CH(NH2)-COOH | Лиз | Lys | К | Н |
| Аргинин | NH2-C(=NH)-NH-(CH2)3- CH(NH2)-COOH | Арг | Arg | R | ПЗ |
| Аспарагиновая к-та | COOH-CH2- CH(NH2)-COOH | Асп | Asp | D | |
| Окончание табл.5.1 | |||||
| Название | Структура (R-CH(NH2)-COOH) | 3-х букв. межд. обозн. | 3-х букв. межд.обозн. | 1-букв. межд. обозн. | ** |
| Аспарагин | NH2-C(=O)-CH2- CH(NH2)-COOH | Асн | Asn | N | |
| Глутаминовая к-та | HOOC-(CH2)2- CH(NH2)-COOH | Глу | Glu | E | |
| Фенилаланин | 
| Фен | Phe | F | Н |
| Глутамин | NH2-C(=O)-(CH2)2- CH(NH2)-COOH | Глн | Gln | Q | |
| Тирозин | 
| Тир | Tyr | Y | ПЗ |
| Триптофан | 
| Три | Trp | W | Н |
| Гистидин | 
| Гис | His | H | Н |
| Пролин | 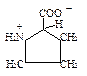
| Про | Pro | P |
Примечание: ** − Н ‒ незаменимая; ПЗ − полузаменимая; остальные – заменимые.
Аминокислоты классифицируются по:
1) строению; 2) характеру заряженности; 3) заменимости-незаменимости.
Классификация по строению:
1. моноаминомонокарбоновые
2. диаминомонокарбоновые (лизин, аргинин, цитруллин)
3. моноаминодикарбоновые (аспарагиновая и глутаминовая кислоты)
4. диаминодикарбоновые (цистин).
Название аминокислот по номенклатуре IUPAC (International Union of Pure and Applied Chemistry − Международный союз чистой и прикладной химии) формируется так, как у карбоновых кислот вообще, с перечислением заместителей, например, имеющихся в углеродной цепи. Лизин, имеющий строение NH2-(CH2)4- CH(NH2)-COOH будет называться 2,6-диаминогексановой, серин − 2-амино-3-гидроксипропановой. На практике названия по номенклатуре IUPAC по отношению к протеиногенным аминокислотам не применяют, обходясь исторически сложившимися тривиальными названиями. Исключение составляют лишь аспарагиновая и глутаминовая кислоты, для которых часто используют названия «аспартат» и «глутамат».
Очень важным свойством аминокислот является строение бокового радикала R, поскольку остальная часть молекулы, включающая карбоксильную группу, аминогруппу, ассиметричный атом углерода и водород для всех протеиногенных аминокислот совершенно одинакова: CH(NH2)-COOH.
Наличие в боковом радикале R функциональных групп, таких, как сульфгидрильная –SH, карбаминовая H2N-C(=O)-, гидроксильная HO-, аминогруппа H2N-, карбоксильная HOOC- и другие, оказывает решающее влияние не только на формирование вторичной, третичной и четвертичной структур белковой молекулы, но и на ее биологические функции. В водных средах при различных значениях рН эти группы отвечают за величину электрических зарядов белковой молекулы, ее растворимость и ряд других физико-химических свойств. Например, замена одного аминокислотного остатка (глутаминовой кислоты в положении 6) в полипептидной цепи субъединицы гемоглобина на остаток валина приводит к такому изменению свойств молекулы гемоглобина, что это вызывает патологию, называемую «серповидноклеточной анемией».
По характеру заряженности боковых радикалов аминокислоты подразделяют на:
неполярные гидрофобные (Гли, Ала, Вал, Лей, Иле, Про, Фен, Тир, Три, Мет);
полярные, но незаряженные (Сер, Тре, Цис, Асн, Глн);
полярные с отрицательным зарядом (Асп, Глу);
полярные с положительным зарядом (Лиз, Арг, Гис).
В зависимости от того, могут ли аминокислоты синтезироваться в организме или должны поступать в составе пищи, различают:
заменимые;
незаменимые (лейцин, изолейцин, валин, лизин, гистидин, метионин, фенилаланин, треонин, триптофан). В детском возрасте также незаменимой является аминокислота аргинин.
Для человека Арг, Тир − полузаменимые, а для курицы − незаменимые.
ЛЕКЦИЯ 6






