Для проведения расчетов в титриметрии пользуются понятием эквивалента и фактора эквивалентности. Эквивалентом называют условную частицу вещества, равноценную в данной реакции одному иону водорода или одному электрону. Фактор эквивалентности (fэкв., 1/ Z) определяет долю реальной частицы вещества, по которой рассчитывается эквивалент. В расчетах, связанных с определением фактора эквивалентности и молярной массы эквивалента, прежде всего необходимо учитывать тип протекающей реакции.
1. В кислотно-основной реакции эквивалент кислоты или основания – такая условная частица вещества, которая в данной реакции высвобождает один ион водорода или соединяется с ним, или каким-либо образом эквивалентна ему. Например, рассчитаем fэкв.(CaCO3) в реакции
CaCO3 + 2H+ + 2Cl– = H2CO3 + Ca2+ + 2Cl–
Отсюда fэкв.(CaCO3) = 1/ Z = 1/2, а молярная масса эквивалента = = М(1/2 CaCO3) = М(CaCO3) ∙ 1/2.
2. В реакции окисления-восстановления эквивалент окисляющегося или восстанавливающегося вещества – это такая условная частица вещества, которая может присоединять или отдавать один электрон в данной химической реакции. Для примера определим fэкв.(Na2S2O3) и продукта его окисления – иона 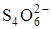 , используя полуреакцию
, используя полуреакцию
2 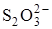 – 2ē D
– 2ē D 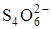 ,
,
в которой участвуют два электрона. Один ион 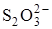 отдает 1 электрон, то есть fэкв.(S2O32–) = fэкв.(Na2S2O3) = 1, а один ион
отдает 1 электрон, то есть fэкв.(S2O32–) = fэкв.(Na2S2O3) = 1, а один ион 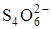 присоединяет 2 электрона (z =2), и fэкв.(
присоединяет 2 электрона (z =2), и fэкв.(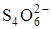 ) = fэкв.(Na2S4O6) = 1/ z = = 1/2 .
) = fэкв.(Na2S4O6) = 1/ z = = 1/2 .
3. В комплексонометрии комплексон III (синонимы – ЭДТА, трилон Б), представляющий собой двунатриевую соль этилендиаминтетрауксусной кислоты – Na2H2Y, в водном растворе диссоциирует с образованием ионов H2Y2–. Для определения fэкв.(комплексона III) и fэкв.(Меn+) используем реакцию
H2Y2– + Меn+ D МеY2– + 2 Н+.
В результате замещения выделяется 2Н+, отсюда следует, что fэкв.(комплексона III) равен 1/2. Особенностью реакции является то, что при взаимодействии H2Y2– с ионами металлов в разной степени окисления (n>2) всегда освобождаются только 2 иона водорода (z =2), и в этом случае fэкв.(комплексона III) = fэкв.(Меn+)= 1/2. Например, при титровании иона Al3+ комплексоном III:
H2Y2– + Al3+ D AlY– + 2 Н+, и fэкв.(Al3+) = 1/2.
4. В случае, если одновременно используются реакции различных типов, например осаждения и окисления-восстановления, комплексообразования и окисления-восстановления и т. д., фактор эквивалентности определяется с помощью пропорции. Расчет фактора эквивалентности показан в примере 18.
Способы титрования
Расчеты результатов анализа зависят от способов титрования. Различают методы прямого титрования, обратного и по заместителю.
В методе прямого титрования к некоторому объему анализируемого вещества (V х) непосредственно добавляют титрант с известной молярной концентрацией эквивалента (СТ). Определив объем титранта (VТ) в т. э., рассчитывают молярную концентрацию эквивалента (С х) или количество молей эквивалента анализируемого вещества (n х) по закону эквивалентов:
С х ∙ V х = СТ ∙ VТ;
n х = nТ;
n х = СТ ∙ VТ.
Массу определяемого вещества (m x) рассчитывают по формуле
m x = n х ∙ M(1/ ZX) ∙ cТ ∙ VТ ∙ M(1/ ZX),
где M(1/ Z X) – молярная масса эквивалента определяемого вещества.
Метод обратного титрования заключается в прибавлении к раствору анализируемого вещества избытка точно известного количества стандартного раствора В и после завершения реакции между ними титровании оставшееся количество вещества В раствором титранта С. Количество молей эквивалента определяемого вещества равно разности между количеством молей эквивалента веществ В и С:
n х = nВ – nС.
В методе титрования по заместителю к определяемому веществу добавляют реагент, вступающий с ним в реакцию. Затем один из продуктов взаимодействия (В) оттитровывают титрантом С. Количество молей эквивалента определяемого вещества при титровании заместителя всегда равно количеству молей эквивалента титранта:
n х = nВ = nС.
РАСЧЕТЫ РЕЗУЛЬТАТОВ
ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА






