Задачи на условия выпадения осадка бывают двух типов. В задачах № 19–21 необходимо рассчитать концентрацию ионов, при которой происходит образование осадка, а в задачах № 22–29 – установить, будет ли выпадать осадок при определенных концентрациях ионов.
Пример 4 поможет Вам при решении задач № 20–21.
Пример 4. При какой молярной концентрации хромата натрия начнется выпадение осадка из 0,001 М раствора нитрата свинца?
Решение. Составим уравнения диссоциации хромата натрия и нитрата свинца:
Na2CrO4 → 2Na+ + 
Pb(NO3)2 → Pb2+ + 2 
Следовательно, молярные концентрации ионов Pb2+ и  совпадают с молярными концентрациями солей.
совпадают с молярными концентрациями солей.
Составим уравнение диссоциации хромата свинца:
PbCrO4↓D Pb2+ + 
 = [Pb2+] ∙ [
= [Pb2+] ∙ [  ] = 1,8 ∙ 10–14.
] = 1,8 ∙ 10–14.
Следовательно, [  ] =
] =  /[Pb2+] = 1,8 ∙ 10–14/0,001 = 1,8 ∙ 10–11 моль/л.
/[Pb2+] = 1,8 ∙ 10–14/0,001 = 1,8 ∙ 10–11 моль/л.
 = [
= [  ] = 1,8 ∙ 10–11 моль/л.
] = 1,8 ∙ 10–11 моль/л.
При решении задач № 20–21 необходимо рассчитать концентрацию осадителя, при которой начнется образование каждого осадка, а затем сравнить их между собой.
При решении задачи № 19 нужно решить систему уравнений для ПР двух малорастворимых соединений и определить отношение концентраций ионов.
Пример 5 поможет Вам при решении задач № 22–29.
Пример 5. Выпадет ли осадок при сливании 100 мл фильтрата, оставшегося от осаждения иодида свинца, с 200 мл 0,1 М раствора хромата натрия?
Решение.  = [Pb2+] ∙ [I–]2 =1,1 ∙ 10–9
= [Pb2+] ∙ [I–]2 =1,1 ∙ 10–9
Химическое равновесие в насыщенном растворе PbI2 описывается уравнением
PbI2↓D Pb2+ + 2I–
Если растворимость PbI2 равна x моль/л, то [Pb2+] = x моль/л, а
[I–] = 2 x моль/л. Следовательно,
 = x ∙ (2 x)2 = 4 х 3= 1,1 ∙ 10–9;
= x ∙ (2 x)2 = 4 х 3= 1,1 ∙ 10–9;
x = 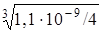 = 6,5 ∙ 10–4 моль/л.
= 6,5 ∙ 10–4 моль/л.
После сливания растворов объем составит
V = 100 + 200 = 300 мл,
а концентрация ионов Pb2+ уменьшится:
 = 6,5 ∙ 10–4 ∙ 100/300 = 2,17 ∙ 10–4моль/л.
= 6,5 ∙ 10–4 ∙ 100/300 = 2,17 ∙ 10–4моль/л.
Соответственно, уменьшится и концентрация иона  :
:
 = 0,1 ∙ 200/300 = 0,067 моль/л.
= 0,1 ∙ 200/300 = 0,067 моль/л.
Для ответа на вопрос о возможности выпадения осадка найдем произведение концентраций (ПС) ионов Pb2+ и  и сравним полученное значение с
и сравним полученное значение с  = 1,8 ∙ 10–14:
= 1,8 ∙ 10–14:
ПС = 2,17 ∙ 10–4 ∙ 0,067 = 1,45 ∙ 10–5 > 1,8 ∙ 10–14.
Следовательно, осадок выпадет.
Расчет растворимости осадков в присутствии
Одноименных ионов
Пример 6 поможет Вам при решении задач № 30–43.
Пример 6. Вычислить концентрацию ионов серебра в насыщенном растворе хлорида серебра, к 1 л которого прибавлено:
а) 1 ∙ 10–4 моля КС1; б) 0,1 моля KCl.
Решение.
a) Хлорид-ионы образуются при диссоциации хлорида серебра и при диссоциации хлорида калия. Тогда будем иметь:
[Ag+] ∙ ([Cl–]AgCl + [С1–]КСl) = ПРАgСl = 1,56 ∙ 10–10
Так как [Ag+] = [Cl–]AgCl, то
[Ag+]2 + [С1–]КСl ∙ [Аg+] – 1,56 ∙ 10–10 = 0
Подставляя значение концентрации КСl и решая квадратное уравнение, получим:
[Ag+] = –10–4/2 +  = 1,54 ∙ 10–6 моль/л.
= 1,54 ∙ 10–6 моль/л.
б) В данном случае значение [С1–]КС1 существенно превышает величину [Cl–]AgCl, поэтому величиной [Cl–]AgCl можно пренебречь. Тогда будем иметь
[Ag+]∙[С1–]КСl = ПРАgСl = 1,56 ∙ 10–10;
[Ag+] = ПРАgСl/ [С1–]КСl = 1,56 ∙ 10–10/0,1 = 1,56 ∙ 10–9 моль/л.
Расчет растворимости осадка в присутствии






