На рис. 3.19 в Т, s -координатах изображен цикл Карно, состоящий из двух изотерм (T = const) и двух адиабат (s = const). Теплота  , подведенная к рабочему телу от теплоисточника при температуре Т 1, эквивалентна согласно формуле площади прямоугольника s 1 АВs 2. А теплота
, подведенная к рабочему телу от теплоисточника при температуре Т 1, эквивалентна согласно формуле площади прямоугольника s 1 АВs 2. А теплота  , отданная теплоприемнику, – площади прямоугольника s 1 DCs 2. Следовательно, работа цикла l ц = q 1 – q 2эквивалентна площади прямоугольника ABCD. Тогда из формулы h t=1- q 2 /q 1 и рис. 3.19 непосредственно следует, что термический к.п.д. цикла Карно равен:
, отданная теплоприемнику, – площади прямоугольника s 1 DCs 2. Следовательно, работа цикла l ц = q 1 – q 2эквивалентна площади прямоугольника ABCD. Тогда из формулы h t=1- q 2 /q 1 и рис. 3.19 непосредственно следует, что термический к.п.д. цикла Карно равен:

и не зависит от природы и свойств рабочего тела, поскольку никаких предположений об этом при изображении данного цикла в T, s -координатах не делалось.

|

|
| Рис. 3.19. Цикл Карно | Рис. 3.20. Сравнение произвольного цикла с циклом Карно |
Используя Т, s -координаты, можно в наглядной форме привести доказательство и второй теоремы Карно, гласящей, что невозможно создать тепловую машину, работающую в том же диапазоне температур (между Т 1 и Т 2), термический КПД которой был бы выше КПД цикла Карно.
Действительно, пусть в некотором диапазоне температур между Т 1 и Т 2 осуществлён некоторый произвольный цикл, изображенный сплошной замкнутой кривой на рис. 3.20. Окружим его циклом Карно, работающим в том же
диапазоне температур и изображенным на рис 3.20 жирными штриховыми линиями. Теплота  , сообщенная рабочему телу в процессе a-b-c данного произвольного цикла (эквивалентная площади под кривой a-b-c), не может быть больше, чем была бы сообщена тому же рабочему телу в цикле Карно при Т = Т 1 (в том же диапазоне увеличения энтропии), т.е.
, сообщенная рабочему телу в процессе a-b-c данного произвольного цикла (эквивалентная площади под кривой a-b-c), не может быть больше, чем была бы сообщена тому же рабочему телу в цикле Карно при Т = Т 1 (в том же диапазоне увеличения энтропии), т.е.  .
.
Аналогично теплота  , отданная рабочим телом в произвольном цикле в процессе c- d-a, не может быть меньше, чем в рассматриваемом цикле Карно:
, отданная рабочим телом в произвольном цикле в процессе c- d-a, не может быть меньше, чем в рассматриваемом цикле Карно:
 .
.
Так как в произвольном цикле  , а в цикле Карно
, а в цикле Карно
 , то, учитывая, что
, то, учитывая, что  , получим
, получим  .
.
3.9. i, s - координаты
Недостатком диаграмм, построенных в Т, s - координатах является необходимость вычислять площади отдельных участков диаграммы при определении теплоты q и работы l процесса, изменения внутренней энергии Δ u и энтальпии Δ i газа. Этого недостатка лишены диаграммы состояния, построенные в i,s - координатах(энтальпия - энтропия), где величины q, l, Δ u и Δ i оделяются по отрезкам прямых. Данная особенность i,s -координат упрощает анализ и расчет термодинамических процессов.

| 
|
| Рис. 3.21. Основные процессы в i,s- координатах | Рис. 3.22. Фрагмент i, s-диаграммы |
Рассмотрим протекание основных процессов с идеальными газами в i,s -координатах (рис. 3.21).
Обратимый адиабатный процесс изображается в координатах i,s, как и в координатах Т,s, прямой вертикальной линией (s = const).
Изотермический процесс. Для идеального газа
 .
.
Так как в этом процессе  , то
, то  . Следовательно,
. Следовательно,  – это горизонтальная линия в i,s -координатах.
– это горизонтальная линия в i,s -координатах.
Изобарный процесс. Здесь
 .
.
Изобара представляет собой кривую линию, тангенс угла наклона касательной к которой равен:  .
.
Так как в изобарном процессе с ростом энтальпии увеличивается температура газа Т, то возрастает и  . Следовательно, как и в Т, s -координатах, изобара обращена выпуклостью к оси абсцисс.
. Следовательно, как и в Т, s -координатах, изобара обращена выпуклостью к оси абсцисс.
Изохорный процесс. По аналогии с изобарным процессом можно записать  ,
,
отсюда  .
.
Следовательно, изохора так же, как и изобара, представляет собой кривую линию, обращенную выпуклостью к оси абсцисс. Взаимное расположение изобары и изохоры в i, s-координатах (см. рис. 3.21) аналогично с их расположением в T,s - координатах.
С помощью i, s-диаграммы (рис. 3.22) можно определить основные термодинамические величины, входящие в формулу первого закона термодинамики. Зная положение точек начала 1 и конца 2 процесса, непосредственно из диаграммы определяются параметры газа в этих точках p 1 ,υ 1, p 2 ,υ 2, кроме того,  и
и  . Изменение энтальпии и энтропии также непосредственно определяется из диаграммы, т.е.
. Изменение энтальпии и энтропии также непосредственно определяется из диаграммы, т.е.  и
и  .
.
Изменение внутренней энергии определим по формуле
 .
.
Тогда величины теплоты и работы в различных процессах определяются следующим образом:
- в изобарном процессе 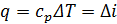 ,
, 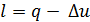 ;
;
- в изохорном процессе  ;
;
- в изотермическом процессе  ,
,  ;
;
- в адиабатном процессе  .
.






