| № п/п | Наименование экспериментальной величины | Обозначение | Единица измерения | Результаты измерений и вычислений |
| Масса металла | m | г | ||
| Объем выделившегося водорода | V1 | мл | ||
| Температура проведения опыта | t | 0С | ||
| Абсолютная температура проведения опыта | T1 | К | ||
| Атмосферное давление проведения опыта | р | мм рт. ст. | ||
| Давление насыщенного водяного пара при данной температуре (табл.2) | h | мм рт. ст. | ||
| Парциальное давление водорода (р1 = р – h) | р1 | мм рт. ст. |
Таблица 1.2
Давление насыщенного водяного пара при различных температурах проведения опыта
| Температура, 0С | Давление пара, мм рт. ст. | Температура, 0С | Давление пара, мм рт. ст. |
| 12,788 | 19,827 | ||
| 13,634 | 21,088 | ||
| 14,530 | 22,377 | ||
| 15,477 | 23,756 | ||
| 16,477 | 25,321 | ||
| 17,535 | 26,532 | ||
| 18,650 | 55,324 |
? 2. Используя объединенный газовый закон, приведите объем выделившегося водорода V1 к нормальным условиям:
V0 = _____________________________________________________
_________________________________________________________
? 3. Запишите закон эквивалентов для данного опыта, учитывая, что один из компонентов находится в газообразном состоянии, и вычислите молярную массу эквивалента магния, определенную экспериментально:
__________________________________________________________
Мэкв(Mg)(экспер) = __________________________________________
? 4. Вычислите теоретическую молярную массу эквивалентов магния, учитывая, что молярная масса магния равна 24,3 г/моль:
Мэкв(Mg)(теор) = ____________________________________________
? 5. Вычислите абсолютную ошибку опыта (А) по формуле:
А = | Мэкв(экспер) – Мэкв(теор) | (1.9)
А = ______________________________________________________
? 6. Вычислите относительную ошибку опыта по формуле:
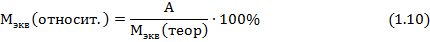
Мэкв(относит.) = ____________________________________________
? 7. Сформулируйте вывод по результату проведенного эксперимента. Если ошибка опыта превышает 5-10 %, то проведите возможные причины.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Вопросы для подготовки к блиц-опросу
1. Что такое моль вещества?
2. Как рассчитать молярную массу веществ?
3. Что такое молярный объем газа?
4. Что такое эквивалент?
5. Как рассчитать молярную эквивалентную массу элемента, оксида, кислоты, основания, соли?
6. В чем сущность закона эквивалентов?
7. Как выражается математически закон эквивалентов?
Таблица 1.3
Результаты оценивания лабораторной работы
| № п/п | Критерий оценивания | Кол-во баллов | |
| максимальное | фактическое | ||
| Правильно проведенный ход работы | 0,5 | ||
| Правильное написание уравнений реакций | 0,5 | ||
| Правильно выполненные расчеты | 0,5 | ||
| Правильно сделанный вывод по работе | 0,5 | ||
| Правильные ответы на вопросы по работе | |||
| ИТОГО |
_____________________ ________________
(подпись преподавателя) (дата)
_____________________ ________________
(подпись студента) (дата)
ЛАБОРАТОРНАЯ РАБОТА № 2
Тема: Классы неорганических веществ
Amp;Тезаурус темы
Оксиды – вещества, состоящие из двух элементов, один из которых кислород.
Кислоты – сложные вещества, при диссоциации которых в водном растворе образуются катионы водорода и анионы кислотного остатка.
Основания – сложные вещества, при диссоциации которых в водном растворе образуются гидроксид-ионы и ионы металлов (или катион аммония).
Амфотерность – свойство веществ проявлять свойства и кислот и оснований.
Соли – сложные вещества, при диссоциации которых в водных растворах образуются катионы металлов (или катион аммония) и анионы кислотного остатка.
Средние соли – соли, представляющие собой продукт полного замещения гидроксогрупп в основаниях и катионов водорода в кислотах.
Кислые соли – соли, образованные как продукты неполного замещения катионов водорода на атомы метала.
Основные соли – соли,образованные как продукты неполного замещения гидроксильных групп основания на кислотные остатки.
Лакмус – индикатор, который в кислой среде окрашивается в красный, в щелочной – в синий, в нейтральной – в фиолетовый цвет.
MЭкспериментальная часть






