25.1. Закончить уравнения реакций: а) Fe + H2SO4 (разб.) = …;
б) Fe + HNO3 (оч. разб.) = …; в) Ni + H2SO4 (конц.) = …; г) Co + HCl = ….
25. 2. Написать в молекулярном и ионном виде уравнения реакций взаимодействия гидроксидов железа (II), кобальта (II) и никеля (III) с соляной кислотой.
25.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3.
25.4. Могут ли в растворе находиться совместно следующие вещества:
а) FeCl3 и SnCl2; б) FeSO4 и NaOH;
в) FeCl3 и K3[Fe(CN)6; г) FeSO4 и K3[Fe(CN)6?
Для взаимодействующих веществ составить уравнения реакций.
25.5. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 + CO = 3FeO + CO2.
Вычислить Δ G° х.р. и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры?
( = –1014,2 кДж/моль;
= –1014,2 кДж/моль; 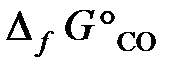 = –137,1 кДж/моль,
= –137,1 кДж/моль,
 = –244,3 кДж/моль,
= –244,3 кДж/моль,  –394,4 кДж/моль).
–394,4 кДж/моль).
(Ответ: 24 кДж).
25.6. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeСl2 → Fe(CN)2 → K4[Fe(CN)6] → K3[Fe(CN)6].
25.7. Закончить уравнения реакций: а) Fe(OH)2 + O2 + H2O = …;
б) Fe(OH)3 + HCl = …; в) Co(OH)3 + HCl = …; г) Ni(OH)3 + HCl = ….
25.8. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ni → Ni(NO3)2 → Ni(OH)2 → Ni(OH)3 → NiCl2.
25.9. Какие степени окисления проявляет железо в своих соединениях? Как можно обнаружить ионы Fe2+ и Fe3+ в растворе? Составить молекулярные и ионные уравнения соответствующих реакций.
25.10. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей: а) FeCl2 + H2O ↔ …; б) NiSO4 + H2O ↔ …;
в) Co(NO3)2 + H2O ↔ …; г) Fe2(SO4)3 + H2O ↔ ….
25.11. Закончить уравнения реакций получения ферратов калия и бария (K2FeO4, BaFeO4): а) KOH + FeCl3 + Br2 = K2FeO4 + …;
б) K2FeO4 + BaCl2 = …; в) Fe2O3 + KNO3 + KOH = KNO2 + ….
25.12. Закончить уравнения реакций образования комплексных соединений и назвать их, учитывая, что координационное число железа равно 6, а кобальта и никеля 4. а) Fe(CN)2 + KCN = …;
б) Co(SCN)2 + NH4SCN (избыток) = …; в) NiSO4 + NH4OH (избыток) = ….
25.13. Сколько часов надо вести электролиз раствора FeSO4, чтобы при силе тока в 2 А выделилось 279,2 г чистого железа? (Ответ: 133,6 ч).
25.14. Рассчитать молярную массу эквивалентов и эквивалент восстановителя в реакции Fe(OH)2 + KMnO4 + H2O = ….
25.15. Определить тепловой эффект реакции 4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
если в реакции участвует 59,2 г FeS2, а энтальпии образования реагирующих веществ равны:  = –148,5 кДж/моль;
= –148,5 кДж/моль; 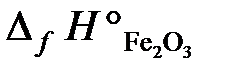 = –803,3 кДж/моль;
= –803,3 кДж/моль;
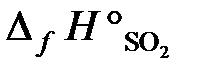 = –297,4 кДж/моль. (Ответ: –418,3 кДж).
= –297,4 кДж/моль. (Ответ: –418,3 кДж).
25.16. Состав комплексной соли кобальта выражается эмпирической формулой CoCl3∙4NH3. При взаимодействии с нитратом серебра осаждается лишь одна треть содержащегося в соли хлора. Учитывая, что координационное число кобальта в этом соединении 6, определить, какие лиганды входят в состав комплексного иона и написать координационную формулу соли.
25.17. По стандартным энтальпиям образования веществ вычислить тепловой эффект реакции, протекающей при выплавке чугуна,
3Fe2O3 + CO = 2Fe3O4 + CO2.
(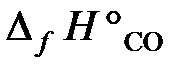 = –110,5 кДж/моль;
= –110,5 кДж/моль;  = –393,5 кДж/моль;
= –393,5 кДж/моль;
 = –822,2 кДж/моль;
= –822,2 кДж/моль;  = –1117,1 кДж/моль).
= –1117,1 кДж/моль).
(Ответ: –50,6 кДж).
25.18. Закончить в молекулярном и ионном виде уравнения качественных реакций на ион Fe3+: а) Fe2(SO4)3 + KOH = …; б) FeCl3 + K4[Fe(CN)6] = …;
в) Fe(NO3)3 + KSCN = ….
25.19. Закончить уравнения реакций: а) FeSO4 + Br2 + H2SO4 = …;
б) FeCl3 + H2S = …; в) FeCl3 + Na2CO3 + H2O = …; г) Fe + HNO3 (разб.) = ….
25.20. Как влияет на коррозию железа его контакт с другими металлами? Какой металл будет разрушаться первым при повреждении поверхности а) луженого, б) оцинкованного; в) никелированного железа? Составить схемы образующихся гальванических элементов. Написать уравнения реакций катодных и анодных процессов.
Галогены
Теоретическое введение
Галогены − фтор, хлор, бром, йод, астат − расположены в главной подгруппе VП группы. Атомы галогенов на внешнем уровне имеют по семь электронов (ns2np5). Характерная степень окисления галогенов −1. Однако все они, кроме фтора, могут проявлять и положительные степени окисления +1, +3, +5, +7. В природе галогены встречаются главным образом в виде отрицательно заряженных ионов, и их получение в свободном состоянии сводится к окислению этих ионов. В качестве окислителей используют МnО2, PbО2, KMnO4, K2Cr2O7, KClO3.
Двухатомные молекулы галогенов неполярны, поэтому они хорошо растворимы в неполярных или слабополярных жидкостях: сероуглероде, бензине, бензоле, хлороформе. Растворимость галогенов в воде сравнительно мала. Фтор в воде не может быть растворен, так как он ее окисляет. В одном объеме воды при 20 °С растворяется 2,5 объема хлора. Этот раствор называется хлорной водой. Растворенный в воде хлор взаимодействует с ней с образованием хлорноватистой НClO и соляной кислот. Хлорноватистая кислота неустойчива и разлагается с образованием атомарного кислорода, вследствие чего хлорная вода обесцвечивает красители.
Йод лучше растворяется в растворе иодида калия. В качестве индикатора для определения йода применяют раствор крахмала. С крахмалом йод образует адсорбционные окрашенные соединения синего цвета, окраска которых исчезает при нагревании.
Свободные галогены являются энергичными окислителями, вступая в реакции с большинством элементов. Окислительная активность галогенов уменьшается от фтора к йоду.
Отрицательные ионы галогенов являются восстановителями (за исключением F‾), причем их восстановительная способность увеличивается от С1− ∙к I−.
Соединения галогенов с водородом – галогеноводороды – бесцветные газы с резким запахом, хорошо растворимы в воде. Их растворы являются кислотами. В ряду HF − НCl − НBr − HI кислотные свойства усиливаются. В этом же ряду возрастает восстановительная активность.
HCl и HF получают обменной реакцией их солей с концентрированной H2SO4. НBr и HI подобным образом получить практически невозможно, так как в реакции с серной кислотой они проявляют сильные восстановительные свойства и окисляются до свободных галогенов. НВг и HI получают гидролизом соединений фосфора PBr3 и PI3.
Кислородные соединения галогенов могут быть получены только косвенным путем. Они представляют собой сравнительно малоустойчивые вещества и являются сильными окислителями.






