17.1. Закончить и уравнять реакции:
а) Ba + H2O = …; б) Sn + NaOH + H2O = …;
в) Sn + HNO3 (разб.) = …; г) Hg + H2SO4 (конц.) = ….
17.2. Закончить и уравнять реакции:
а) Cd + H2SO4 (разб.) = …; б) Be + NaOH + H2O = …;
в) Bi + HNO3 (конц.) = …; г) Li + H2O = ….
17.3. Какие из перечисленных металлов (Mg, Mn, Hg, Au, Al, Cd, Ag) растворяются в разбавленной H2SO4? Написать уравнения реакций.
17.4. Закончить и уравнять реакции:
а) Mg + HNO3 (разб.) = …; б) Sn + KOH + H2O = …;
в) Ni + H2SO4 (конц.) = …; г) W + HNO3 + HF = H2[WF8] + ….
17.5. Закончить и уравнять реакции:
а) Ga + NaOH + H2O = …; б) Bi + HNO3 (разб.) = …;
в) La + H2O =* …; г) Co + H2SO4 (конц.) = ….
*Электродный потенциал лантана –2,55 В.
17.6. Закончить и уравнять реакции:
а) Rb + H2O = …; б) W + Na2CO3 + NaNO3  Na2WO4 + …;
Na2WO4 + …;
в) Be + KOH + H2O = …; г) Sn + HCl = ….
17.7. Закончить и уравнять реакции:
а) Pb + NaOH + H2O = …; б) Fe + O2 = …;
в) Ni + HNO3 (конц.) = …; г) La + H2SO4 (разб.) =* ….
* Электродный потенциал лантана –2,55 В.
17.8. Закончить и уравнять реакции:
а) Ga + H2SO4 (разб.) =* …; б) Cd + HNO3 (конц.) = …;
в) Sr + H2O =* …; г) Al + C  ….
….
* Электродный потенциал стронция –2,88 В, галлия –0,53 В.
17.9. Закончить и уравнять реакции:
а) Mn + HNO3 (разб.) = …; б) Al + KOH + H2O = …;
в) Ca + H2O = …; г) Fe + H2SO4 (разб.) = ….
17.10. Закончить и уравнять реакции:
а) Ta + HNO3 + HF = H2[TaF7] + …; б) Cs + H2O = …;
в) Ag + HNO3 (разб.) = …; г) Al + HCl = ….
17.11. Закончить и уравнять реакции:
а) Zr + HNO3 + HCl = ZrCl4 + …; б) Rb + H2O = …;
в) Mn + HNO3 (конц.) = …; г) Sn + KOH + H2O = ….
17.12. Закончить и уравнять реакции:
а) Mo + NaNO3 + NaOH  Na2MoO4 + …; б) Ni + H2SO4 (разб.) = …;
Na2MoO4 + …; б) Ni + H2SO4 (разб.) = …;
в) Ni + H2SO4 (конц.) = …; г) Mg + H2O  ….
….
17.13. Закончить и уравнять реакции:
а) Na + H2 = …; б) Zn + CH3COOH = …;
в) Sn + H2SO4 (конц.) = …; г) Ca + HNO3 (оч. разб.) = ….
17.14. Закончить и уравнять реакции:
а) Hg + HNO3 + HCl = HgCl2 + …; б) Co + HNO3 (конц.) = …;
в) K + H2O = …; г) Sc + H2SO4 (разб.) =* ….
* Электродный потенциал скандия –2,01 В.
17.15. Какие из перечисленных металлов (Cu, Ca, Hg, Au, Fe, Cr, Ag, Al) растворяются в HCl? Написать уравнения реакций.
17.16. Закончить и уравнять реакции:
а) Nb + HNO3 + HF = H2[NbF7] + …; б) Li + N2 = …;
в) Pb + KOH + H2O = …; г) Fe + HNO3 (разб.) = ….
17.17. Закончить и уравнять реакции:
а) V + KOH + O2  КVО3 + …; б) Sn + HNO3 (конц.) = H2SnO3 + …;
КVО3 + …; б) Sn + HNO3 (конц.) = H2SnO3 + …;
в) Ag + H2SO4 (конц.)  …; г) Mn + H2SO4 (разб.) = ….
…; г) Mn + H2SO4 (разб.) = ….
17.18. Закончить и уравнять реакции:
а) Pt + HNO3 + HCl = H2[PtCl6] + …; б) Fe + H2SO4 (конц.)  …;
…;
в) Al + S  …; г) Sn + KOH + H2O = ….
…; г) Sn + KOH + H2O = ….
17.19. Закончить и уравнять реакции:
а) Fe + Cl2 = …; б) Be + KOH + H2O = …;
в) Cd + HNO3 (разб.) = …; г) Sn + H2SO4 (разб.) = ….
17.20. Закончить и уравнять реакции:
а) Ca + H2 = …; б) Mn + HCl = …;
в) Mo + Na2CO3 + NaNO3 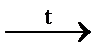 Na2MoO4 + …; г) Cd + HNO3 (разб.) = ….
Na2MoO4 + …; г) Cd + HNO3 (разб.) = ….
Комплексные соединения
Теоретическое введение
Соединения, в состав которых входят комплексные ионы, способные существовать как в кристаллах, так и в растворах, называются комплексными. Комплексные соединения могут быть получены при взаимодействии нейтральных молекул:
Fe(CN)3 + 3KCN = K3[Fe(CN)6]; BF3 + KF = K[BF4].
В молекуле комплексного соединения один атом или ион, обычно положительно заряженный, занимает центральное место и называется комплексообразователем. В непосредственной близости к нему расположены или координированы противоположно заряженные ионы или нейтральные молекулы, называемые лигандами. Комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения. Число лигандов, расположенных вокруг комплексообразователя, называется координационным числом. Чаще всего координационное число равно 6, 4 и 2. В формулах комплексных соединений внутреннюю сферу обозначают квадратными скобками. Все остальные ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу.
При растворении в воде комплексные электролиты диссоциируют на внутреннюю и внешнюю сферу: [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl‾. Наряду с этим происходит и другой процесс, хотя в значительно меньшей степени:
[Ag(NH3)2]+ ↔ Ag+ + 2NH3. Здесь диссоциация протекает обратимо и равновесие резко сдвинуто влево. Константа диссоциации комплексного иона
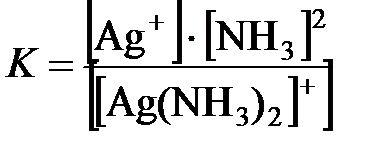
называется константой нестойкости (К н). Она характеризует устойчивость комплекса. Чем меньше константа нестойкости, тем прочнее комплексный ион в растворе.
Примеры решения задач
Пример 18.1. Определить заряд комплексного иона, координационное число комплексообразователя (к.ч.) и степень окисления комплексообразователя в соединениях: а) [Cr(H2O)4Cl2]Cl, б) K3[Fe(CN)6], в) [Cu(NH3)4]SO4.
Решение. Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координирующихся вокруг него. Степень окисления комплексообразователя определяется так же, как степень окисления атома в любом соединении, исходя из того, что сумма степеней окисления всех атомов в молекуле равна нулю. Заряды нейтральных молекул (Н2О, NH3) равны нулю. Заряды кислотных остатков определяют из формул соответствующих кислот. Отсюда: заряд иона а) +1, б) −3, в) +2; координационное число а) 6, б) 6, в) 4;
степень окисления а) +3, б) +3, в) +2
Пример 18.2. Назвать комплексные соли: [Cu(NH3)4]SO4, [Co(Н2О)4(NO2)2]Cl, K4[Fe(CN)6], Na2[Pt(OH)5Cl], [Pt(NH3)2Cl2], [Cu(NH3)2(SCN)2].
Решение. При составлении названия комплексного соединения первым в именительном падеже называется анион, в потом в родительном – катион, независимо, который из них является комплексным.
1. Соль содержит комплексный катион. Название комплексного катиона составляют следующим образом: сначала указывают числа (ди, три, тетра, пента, гекса и т.д.) и названия отрицательно заряженных лигандов с окончанием «о» (Cl‾ – хлоро, SO42− – сульфато, ОН− – гидроксо, CN‾ – циано. SCN− – родано, NO2− – нитро и т.п.); затем указывают числа и названия нейтральных лигандов, причем вода называется аква, аммиак – аммин; последним называют комплексообразователь, указывая его степень окисления (в скобках римскими цифрами после названия комплексообразователя). Например, [Cu(NH3)4]SO4 – сульфат тетраамминмеди (II); [Co(Н2О)4(NO2)2]Cl – хлорид динитротетрааквакобальта (III).
2. Соль содержит комплексный анион. Название комплексного аниона составляют аналогично названию катиона и заканчивают суффиксом «ат». Например, K4[Fe(CN)6] − гексацианоферрат (II) калия; Na2[Pt(OH)5Cl] – хлоропентагидроксоплатинат (IV) натрия.
3. Наименование нейтральных комплексов образуют так же, как и катионов, но комплексообразователь называют в именительном падеже, а его степень окисления не указывают. Например, [Pt(NH3)2Cl2] – дихлородиамминплатина; [Cu(NH3)2(SCN)2] – дироданодиамминмеди.






