14.1. а). Исходя из степени окисления серы в веществах S, H2S, Na2SO3, H2SO4, определить, какое из них является только окислителем, только восстановителем и какие могут быть и окислителем, и восстановителем. Ответ обосновать.
б). На основании электронных уравнений подобрать коэффициенты в уравнении реакции, идущей по схеме: NaI + NaIO3+ H2SO4 ® I2+ Na2SO4 + H2O.
Определить тип окислительно-восстановительной реакции.
14.2. Реакции выражаются схемами:
Zn + HNO3 (разб) ® Zn(NO3)2 + N2O + H2O;
SnCl2 + K2Cr2O7 + H2SO4 ® Sn(SO4)2 + CrCl3 + K2SO4 + H2O.
Составить электронные уравнения, подобрать коэффициенты, указать, какое вещество в каждой реакции является окислителем, какое восстановителем.
14.3. а). Составить электронные уравнения и указать, какой процесс (окисление или восстановление) происходит при следующих превращениях:
P–3 ® P+5; N+3 ® N–3; Cl– ® (ClO3)–; (SO4)2− ® S–2.
б). Реакция выражается схемой
KMnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O.
Определить окислитель и восстановитель, на сновании электронных уравнений расставить коэффициенты в уравнении реакции.
14.4. а). Могут ли протекать окислительно-восстановительные реакции между веществами: а) Cl2 и H2S; б) KBr и KBrO; в) HI и NH3? Ответ обосновать.
б). На основании электронных уравнений подобрать коэффициенты, определить тип окислительно-восстановительной реакции, идущей по схеме
NaCrO2 + PbO2 + NaOH ® Na2CrO4 + Na2PbO2 + H2O.
14.5. а). Возможные степени окисления железа в соединениях +2, +3, +6. Определить, какое из веществ может быть только восстановителем, только окислителем и какое – и окислителем и восстановителем: FeSO4, Fe2O3, K2FeO4. Ответ обосновать.
б). На основании электронных уравнений подобрать коэффициенты для веществ в уравнении реакции, идущей по схеме
CrCl3 + Br2 + NaOH ® Na2CrO4 + NaBr + NaCl + H2O.
14.6. а). Составить электронные уравнения и указать, какой процесс (окисление или восстановление) происходит при следующих превращениях:
As+3 ® As+5; (CrO4)2– ® (CrO2)–; (MnO4)– ® (MnO4)2–; Si+4 ® Si0.
б). На основании электронных уравнений расставить коэффициенты в реакции, идущей по схеме H2S + H2SO3 ® S + H2O.
14.7. Реакции выражаются схемами:
NaNO3 ® NaNO2 + O2;
MnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O.
Составить электронные уравнения, расставить коэффициенты, определить окислитель и восстановитель в каждой реакции. К какому типу относится каждая из приведенных реакций?
14.8. См. условие задания 14.7.
KBr + KBrO3 + H2SO4 ® Br2 + K2SO4 + H2O;
NH4NO3 ® N2O + H2O.
14.9. См. условие задания 14.7.
H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2 O;
NaBrO ® NaBrO3 + NaBr.
14.10. а). Исходя из степени окисления хлора определить и дать мотивированный ответ, какое из соединений Cl2, HCl, HClO4 является только окислителем, только восстановителем и какое из них может иметь функцию и окислителя, и восстановителя.
б). На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме HNO3 + Bi ® NO + Bi(NO3)3 + H2O.
14.11. См. условие задания 14.7.
H3AsO3 + KMnO4 + H2SO4® H3AsO4 + MnSO4 + K2SO4 + H2O;
AgNO3 ® Ag + NO2 + O2.
14.12. а). Могут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и Br2; б) HI и HIO3; в) KMnO4 и K2Cr2O7? Ответ обосновать.
б). На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме
H2O2 + KMnO4 + H2SO4 ® O2 + MnSO4 + K2SO4 + H2O.
14.13. а). Составить электронные уравнения и указать, какой процесс (окисление или восстановление) происходит при следующих превращениях:
(BrO4)– ® Br2; Bi ® (BiO3)–; (VO3)–®V; Si–4 ® Si+4.
б). На основании электронных уравнений подобрать коэффициенты в уравнении реакции, идущей по схеме
Al + KMnO4 + H2SO4 ® Al2(SO4)3 + MnSO4 + K2SO4 + H2O.
14.14. См. условие задания 14.7.
Na2SO3 + Na2S + H2SO4 ® S + Na2SO4 + H2O;
KMnO4 ® K2MnO4 + MnO2 + O2.
14.15. а). Могут ли идти окислительно-восстановительные реакции между следующими веществами: а) PbO2 и KBiO3; б) Н2S и Н2SO3; в) H2SO3 и HClO4? Ответ обосновать.
б). На основании электронных уравнений расставить коэффициенты в уравнении реакции, идущей по схеме S + KOH ® K2SO3 + K2S + H2O.
Определить тип окислительно-восстановительной реакции.
14.16. См. условие задания 14.7.
(NH4)2Cr2O7 ® N2 + Cr2O3 + H2O;
P + HNO3 + H2O ® H3PO4 + NO.
14.17. См. условие задания 14.7.
Ba(OH)2 + I2 ® Ba(IO3)2 + BaI2 + H2O;
MnSO4 + PbO2 + HNO3 ® HMnO4 + Pb(NO3)2 + PbSO4 + H2O.
14.18. См. условие задания 14.7.
AgNO3 + H2O2 + KOH ® Ag + O2 + KNO3 + H2O;
Ni(NO3)2 ® NiO + NO2 + O2.
14.19. На основании электронных уравнений расставить коэффициенты в уравнениях реакций, идущих по схемам
HNO2 ® HNO3 + NO + H2O;
Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O.
Указать окислитель и восстановитель в каждой реакции, определить ее тип.
14.20. См. условие задания 14.7.
Si + O2 + NaOH ® Na2SiO3 + H2O;
NH4NO2 ® N2 + H2O.
Коррозия металлов
Теоретическое введение
Коррозией называется самопроизвольное разрушение металлов под воздействием окружающей среды. По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
Химической коррозией называется окисление металла, не сопровождающееся возникновением в системе электрического тока. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и жидкими неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока. Электрохимическая коррозия протекает по механизму действия гальванического элемента. На поверхности металла одновременно протекают два процесса:
анодный – окисление металла:
М – nē → Mn+,
катодный – восстановление окислителя:
Ox + nē → Red.
Наиболее распространенными окислителями при электрохимической коррозии являются молекулы O2 воздуха и ионы H+ электролита. Восстановление на катоде молекул О2 и ионов Н+ протекает по уравнениям:
O2 + 2H2O + 4 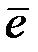 = 4OH‾ − в щелочной или нейтральной среде,
= 4OH‾ − в щелочной или нейтральной среде,
2H+ + 2 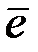 = H2 − в кислой среде.
= H2 − в кислой среде.
Металлы, применяемые в технике, содержат примеси других металлов, поэтому при соприкосновении с раствором электролита на их поверхности образуется большое количество непрерывно действующих микрогальванических элементов. Разрушается более активный металл. Например, при контакте железа с медью в присутствии электролита – соляной кислоты – возникает гальванический элемент:
(анод) (−) Fe | HCl | Cu (+) (катод)
и происходит электрохимическая коррозия.
На аноде идет процесс окисления: Fe0 − 2ē = Fe2+
На катоде – процесс восстановления: 2H+ + 2ē = H2
В результате железо разрушается в месте контакта, а на меди выделяется водород.
При контакте железа с медью во влажном воздухе образуется гальванический элемент (−) Fe | H2O, О2 | Cu (+) и процесс коррозии выражается уравнениями:
на аноде Fe0 − 2ē = Fe2+
на катоде O2 + 2H2O + 4ē = 4OH‾
2Fe + O2 + 2H2O = 2Fe(OH)2.
Под влиянием кислорода воздуха гидроксид железа (II) окисляется по уравнению: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. Далее Fe(OH)3 частично теряет воду и превращается в ржавчину.
Одним из важнейших методов защиты металлов от коррозии являются защитные покрытия металлов, которые изолируют металл от внешней среды и могут быть неметаллическими (лаки, краски, эмали) и металлическими. Различают катодные и анодные металлические покрытия. Покрытие защищаемого металла менее активным металлом называется катодным, например, луженое железо. Покрытие защищаемого металла более активным называется анодным, например, оцинкованное железо. В случае нарушения целостности покрытий и наличия раствора электролита разрушается более активный металл. Так, в случае хромированного железа (анодное покрытие) будет разрушаться хром: (−) Cr | HCl | Fe (+)
на аноде Cr0 − 3ē = Cr3+
на катоде 2H+ + 2ē = H2.
В случае никелированного железа (катодное покрытие) разрушается железо: (−) Fe | HCl | |Ni (+)
на аноде Fe0 − 2ē = Fe2+
на катоде 2H+ + 2ē = H2.
Примеры решения задач
В узлах кристаллической решетки металлов расположены атомы и положительно заряженные ионы. Между узлами перемещаются валентные электроны. Эти электроны не имеют связи с отдельными ионами, а являются общими, принадлежащими всем ионам металла.
Если погрузить металл в воду или раствор его соли, то часть ионов металла, находящихся на поверхности, взаимодействует с полярными молекулами воды и переходит в раствор в виде гидратированных ионов. Вследствие этого раствор вблизи поверхности металла заряжается положительно, а на самом металле создается избыток электронов, придающих металлу отрицательный заряд.
Таким образом, на границе металл – раствор образуется двойной электрический слой и возникает определенный скачок потенциала. Разность потенциалов, которая возникает на границе металл – раствор, называется электродным потенциалом. Абсолютное значение электродного потенциала измерить невозможно. Поэтому электродные потенциалы определяют относительно стандартного водородного электрода, потенциал которого условно принят за ноль.
Разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом называется стандартным электродным потенциалом металла. Обозначается j0, измеряется в вольтах (В). Значения некоторых стандартных электродных потенциалов приведены в табл. Б.4.
Расположенные в порядке увеличения стандартного электродного потенциала металлы образуют ряд напряжений металлов. Положение металла в ряду напряжений определяет относительную окислительно-восстановительную способность металла и его ионов. Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы. Каждый металл способен вытеснять из растворов солей только те металлы, которые имеют большее значение электродного потенциала – более активный металл замещает менее активный.
Последовательность металлов в ряду напряжений сохраняется только для стандартной температуры (25 °С) и концентрации ионов металла в растворе 1 моль/л. При других концентрациях электролита электродный потенциал рассчитывается по уравнению Нернста:
j = j ° + 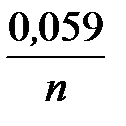 lg C,
lg C,
где j ° − стандартный электродный потенциал, n – число электронов, участвующих в электродной реакции; C – концентрация ионов металла в растворе, моль/л.
Если два электрода, погруженные в растворы электролитов, соединить металлическим проводником, образуется гальванический элемент. Гальваническими элементами называют устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
Так, реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля – Якоби, схема которого
(–) Zn | ZnSO4 || CuSO4 |Cu (+)
отражает систему обозначений для гальванических элементов. Слева записывается анод Zn | Zn2+ – электрод, имеющий меньшее значение электродного потенциала, отрицательный полюс (–), на нем протекает процесс окисления – анодная реакция: Zn –2ē = Zn2+. Справа – катод Cu2+| Cu – электрод, имеющий большее значение электродного потенциала, положительный полюс (+), на нем протекает процесс восстановления – катодная реакция: Cu2+ + 2ē = Cu. Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное и катодное пространство.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей. В случае элемента Даниэля – Якоби токообразующая реакция имеет вид
Cu2+ + Zn = Cu + Zn2+.
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода:
E = j к – j а.
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода: E° = j ° к– j ° а Так, для элемента Даниэля – Якоби стандартная ЭДС равна E° = j ° Сu2+/Cu – j ° Zn2+/Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае D G° х.р. < 0, так как энергия Гиббса химической реакции и ЭДС связаны соотношением
DG° = – nE°F,
где n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея, равная 96500 Кл; E° – стандартная ЭДС.
Гальванический элемент, состоящий из двух электродов одного и того же металла, погруженных в растворы его соли разной концентрации, представляет собой концентрационный элемент. В этом случае электрод, погруженный в раствор электролита с меньшей концентрацией ионов металла, будет анодом. В качестве катода будет выступать электрод, опущенный в электролит с большей концентрацией ионов металла.
Пример 15.1. Определить ЭДС концентрационного серебряного элемента с концентрациями ионов серебра, равными 10–1 моль/л у одного электрода и
10-4 моль/л у другого при 298 К.
Решение. Схема такого гальванического элемента Ag½Ag+||Ag+½Ag. По уравнению Нернста рассчитываем потенциалы двух серебряных электродов.
Для первого электрода
j Ag+/Ag = j ° Ag+/Ag + 0,059 lg 10-1 = 0,799 + 0,059×(–1) = 0,74 В.
Для второго электрода
j Ag+/Ag = j ° Ag+/Ag + 0,059 lg 10-4 = 0,799 + 0,059×(–4) = 0,563 В.
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле
E = j к – j а = 0,74 – 0,563 = 0,177 В.
Пример 15.2. Рассчитать ЭДС элемента Cd½Cd2+ || Ni2+½Ni при концентрации ионов Cd2+ и Ni2+, равных соответственно 0,1 и 0,001 моль/л.
Решение. Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы Cd и Ni:
j Сd2+/Cd = j ° Сd2+/Cd + 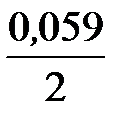 lg 10-3 = –0,403 + 0,0295×(–3) = –0,4915 В;
lg 10-3 = –0,403 + 0,0295×(–3) = –0,4915 В;
j Ni2+/Ni = j ° Ni2+/Ni + 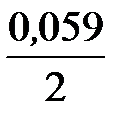 lg 10-1 = –0,250 + 0,0295×(–1) = –0,2795 В.
lg 10-1 = –0,250 + 0,0295×(–1) = –0,2795 В.
Так как j Сd2+/Cd < j Ni2+/Ni, то токообразующей в этом гальваническом элементе является реакция Cd0 + Ni2+ = Cd2+ + Ni0. Рассчитываем ЭДС элемента
E = j Ni2+/Ni – j Сd2+/Cd = –0,2795 – (–0,4915) = 0,212 В.
Пример 15.3. Исходя из значений стандартных электродных потенциалов и D G °х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb2+ + Ti = Pb + Ti2+. Составить схему гальванического элемента, написать уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом:
(–) Ti½Ti2+|| Pb2+½Pb (+).
Уравнения электродных реакций имеют вид:
на аноде Ti0 – 2ē ® Ti2+
на катоде Pb2++ 2ē ® Pb0
Рассчитываем стандартное значение ЭДС:
E° = j ° к – j ° а = j ° Pb2+/Pb – j ° Ti2+/Ti = –0,126 – (–1,628) = 1,502 B.
Энергию Гиббса рассчитываем по уравнению D G = –nE°F = –2×1,502×96500 = = –289,9 кДж. Так как D G° < 0, токообразующая реакция возможна.
Пример 15.4. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составить молекулярные и ионные уравнения соответствующих реакций.
Решение. В соответствии со значениями стандартных электродных потенциалов ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4, Cu2+ + Zn = Cu + Zn2+;
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2, Pb2+ + Zn = Pb + Zn2+.
Один моль эквивалентов цинка (32,69 г/моль) будет замещаться на один моль эквивалентов меди (31,77 г/моль) или свинца (103,6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 15.5. Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии.
Решение. Цинк имеет меньшее значение потенциала (–0,763 В), чем кадмий
(–0,403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода.
Анодный процесс Zn – 2ē = Zn2+.
Катодный процесс 2Н+ + 2ē ® Н2 (в кислом растворе);
О2 + 2Н2О + 4ē ® 4ОН– (во влажном воздухе).
Схема образующегося гальванического элемента во влажном воздухе:
(–) Zn | O2, H2O½Cd (+).
Схема образующегося гальванического элемента в кислом растворе:
(–) Zn½HCl½Cd (+).
Во влажном воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+.
Пример 15.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (HCl)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
Решение. По положению в ряду напряжений металлов видно, что хром более активный металл (j ° Сr3+/Cr = –0,744 В), чем медь (j ° Сu2+/Cu = 0,337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из HCl.
Анодный процесс: Cr –3ē = Cr3+
Катодный процесс в кислой среде: 2Н+ + 2ē ® Н2
Схема гальванического элемента: (–) Cr½HCl½Cu (+)
Появляющиеся ионы Cr3+ образуют с хлорид-анионами (из HCl) растворимое соединение – CrC13, на поверхности меди выделяется Н2.






