7.1. Реакция протекает по уравнению 3Н2 + СО = СН4 + H2O.
Начальные концентрации реагирующих веществ были (моль/л): 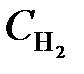 = 0,8; C CO = 0,6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1,2, а концентрацию оксида углерода до 0,9 моль/л?
= 0,8; C CO = 0,6. Как изменится скорость реакции, если концентрацию водорода увеличить до 1,2, а концентрацию оксида углерода до 0,9 моль/л?
(Ответ: увеличится в 5 раз).
7.2. Реакция разложения N2O идет по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5·10–4. Начальная концентрация 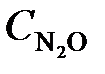 = 0,32 моль/л.
= 0,32 моль/л.
Определить скорость реакции в начальный момент и в тот момент, когда разложится 50 % N2O. (Ответ: 5,12 . 10-5; 1,28 . 10-5).
7.3. Реакция между веществами А и В выражается уравнением А + 2В = D. Начальные концентрации (моль/л): С А = 0,3 и С В = 0,4. Константа скорости равна 0,8. Вычислить начальную скорость реакции и определить, как изменилась скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,1 моль. (Ответ: 3,84 . 10-2; уменьшилась в 6 раз).
7.4. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 30 °С, время протекания реакции увеличилось в 64 раза? (Ответ: 4).
7.5. Вычислить, при какой температуре реакция закончится за 45 мин, если при 20 °С на это потребуется 3 ч. Температурный коэффициент скорости реакции равен 3. (Ответ: 33 °С).
7.6. Как изменится скорость реакции CO + Cl2 = COCl2, если повысить давление в 3 раза и одновременно повысить температуру на 30 °С (γ = 2)?
(Ответ: увеличится в 72 раза).
7.7. Реакции протекают по уравнениям:
С (к) + О2 (г) = СО2 (г); (1)
2СО (г) + О2 (г) = 2СО2 (г). (2)
Как изменится скорость (1) и (2) реакций, если в каждой системе: а) уменьшить давление в 3 раза; б) увеличить объем сосуда в 3 раза; в) повысить концентрацию кислорода в 3 раза? (Ответ: а) уменьшится в (1) в 3, во (2) в 27 раз;
б) уменьшится в (1) в 3, во (2) в 27 раз; в) увеличится в (1) и (2) в 3 раза).
7.8. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости равна 0,16. Исходные концентрации Н2 и I2 соответственно равны 0,04 и 0,05 моль/л. Вычислить начальную скорость реакции и ее скорость, когда концентрация Н2 станет равной 0,03 моль/л. (Ответ: 3,2 . 10-4; 1,9 . 10-4).
7.9. Окисление серы и ее диоксида протекает по уравнениям:
S (к) + О2 (г) = SO2 (г); (1)
2SO2 (г) + О2 (г) = 2SO3 (г). (2)
Как изменится скорость (1) и (2) реакций, если в каждой системе: а) увеличить давление в 4 раза; б) уменьшить объем сосуда в 4 раза; в) повысить концентрацию кислорода в 4 раза? (Ответ: а) увеличится в (1) в 4, во (2) − в 64 раза; б) увеличится в (1) в 4, во (2) − в 64 раза; в) увеличится в (1) и (2) в 4 раза.
7.10. Константа скорости реакции 2А + В = D равна 0,8. Начальные концентрации (моль/л): С А = 2,5 и С В = 1,5. В результате реакции концентрация вещества С В оказалась равной 0,6 моль/л. Вычислить, чему стала равна С А и скорость реакции. (Ответ: 0,7 моль/л; 0,235).
7.11. Реакция протекает по уравнению
4HCl + O2 = 2H2O + 2Cl2.
Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 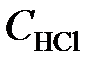 = 0,85;
= 0,85; 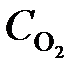 = 0,44;
= 0,44; 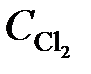 = 0,30. Вычислить начальные концентрации HCl и О2. (Ответ:
= 0,30. Вычислить начальные концентрации HCl и О2. (Ответ: 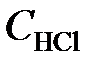 = 1,45;
= 1,45; 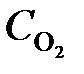 = 0,59 моль/л).
= 0,59 моль/л).
7.12. Начальные концентрации веществ в реакции СО + Н2О ↔ СО2 + Н2 были равны (моль/л): C CO = 0,5; 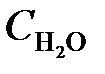 = 0,6;
= 0,6; 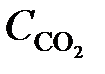 = 0,4;
= 0,4; 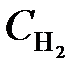 = 0,2. Вычислить концентрации всех участвующих в реакции веществ после того, как прореагировало 60 % Н2О. (Ответ: C CO = 0,14;
= 0,2. Вычислить концентрации всех участвующих в реакции веществ после того, как прореагировало 60 % Н2О. (Ответ: C CO = 0,14; 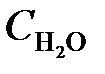 = 0,24;
= 0,24; 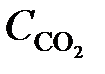 = 0,76;
= 0,76; 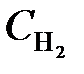 = 0,56 моль/л).
= 0,56 моль/л).
7.13. Как изменится скорость реакции 2СО + О2 = СО2, если: а) объем реакционного сосуда увеличить 3 раза; б) увеличить концентрацию СО в 3 раза; в) повысить температуру на 40 °С (γ = 2)? (Ответ: а) уменьшится в 27 раз; б) увеличится в 9 раз; в) увеличится в 16 раз).
7.14. При 10 °С реакция заканчивается за 20 мин. Сколько времени будет длиться реакция при повышении температуры до 40 °С, если температурный коэффициент равен 3? (Ответ: 44,4 с).
7.15. Во сколько раз следует увеличить а) концентрацию СО в системе 2СО = СО2 + С, чтобы скорость реакции возросла в 4 раза? б) концентрацию водорода в системе N2 + 3H2 = 2NH3, чтобы скорость реакции возросла в 100 раз? в) давление в системе 2NO + O2 = 2NO2, чтобы скорость образования NO2 возросла в 103 раз? (Ответ: 2 раза; 4,64 раза; 10 раз).
7.16. Скорость реакции А + 2В = АВ2 при С А = 0,15 и С В = 0,4 моль/л равна 2,4∙10−3. Определить константу скорости и скорость реакции, когда концентрация В станет 0,2 моль/л. (Ответ: 0,1; 2∙10-4).
7.17. Как изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 3 раза, концентрацию вещества В уменьшить в 2 раза, а температуру повысить на 40 °С (γ = 2)? (Ответ: увеличится в 72 раза).
7.18. Реакция идет по уравнению 2H2S + 3O2 = 2SO2 + 2H2O. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): 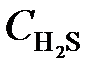 = 0, 009;
= 0, 009; 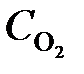 = 0,02;
= 0,02; 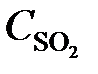 = 0,003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации сероводорода и кислорода. (Ответ:
= 0,003. Вычислить: а) концентрацию водяного пара в этот момент; б) исходные концентрации сероводорода и кислорода. (Ответ: 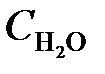 = 0,003;
= 0,003; 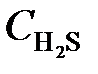 = 0,012;
= 0,012; 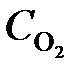 = 0,0245 моль/л).
= 0,0245 моль/л).
7.19. Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй – 3. Найти отношение этих скоростей при 75 °С. (Ответ: V 2/ V 1 = 7,59).
7.20. Реакция идет по уравнению N2 + 3H2 = 2NH3. Через некоторое время после начала реакции концентрации реагирующих веществ были (моль/л):
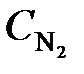 = 0,8;
= 0,8; 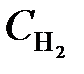 = 1,5;
= 1,5; 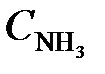 = 0,1. Вычислить концентрации веществ в момент, когда концентрация N2 стала 0,5 моль/л. (Ответ:
= 0,1. Вычислить концентрации веществ в момент, когда концентрация N2 стала 0,5 моль/л. (Ответ: 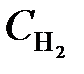 = 0,6;
= 0,6; 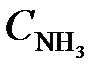 = 0,7 моль/л).
= 0,7 моль/л).
Катализ
Теоретическое введение
Катализаторами называются вещества, увеличивающие скорость химических реакций, но сами остающиеся после нее химически неизменными. Явление изменения скорости реакции под воздействием катализаторов называется катализом.
Катализатор бывает гомогенный и гетерогенный. Если катализатор и реагирующие вещества находятся в одном фазовом состоянии, то катализ называют гомогенным. Механизм гомогенного катализа объясняется возникновением при участии катализатора нестойких промежуточных соединений. При этом энергия активации понижается и активными становятся молекулы, энергия которых была недостаточна для осуществления реакции без катализатора. Например, реакция
2SO2 (г) + O2 (г) → 2SO3 (г)
протекает с малой скоростью. Для увеличения скорости реакцию проводят в присутствии катализатора NO, который с одним из реагентов, а именно с О2, образует нестойкое промежуточное соединение NO2, взаимодействующее в свою очередь с другим реагентом SO2:
О2 (г) + 2NO (г) → 2NO2 (г)
2NO2 (г) + 2SO2 (г) → 2SO3 (г) + 2NO (г)
О2 (г) + 2SO2 (г) → 2SO3 (г).
Как видим, в суммарное уравнение реакции катализатор не входит, т.е. в результате реакции он не испытывает химическое превращение.
Если катализатор и взаимодействующие вещества находятся в разных фазовых состояниях, т. е. имеют границу раздела, то катализ называют гетерогенным. В этом случае катализаторами обычно являются твердые вещества, на поверхности которых реагируют жидкости или газы. Суммарная скорость реакции на твердом катализаторе зависит от площади его поверхности, поэтому для ускорения реакции применяют катализаторы с развитой поверхностью: тонко измельченные порошки или подложки (пористые угли, силикаты) с нанесенным тонким слоем катализатора. Гетерогенные каталитические реакции начинаются со стадии адсорбции, в результате которой разрываются или ослабляются химические связи в молекулах реагирующих веществ, и молекулы становятся активными.
Примеры решения задач
Пример 8.1. Промышленная установка, работающая на ванадиевом катализаторе (V2O5), производит в сутки 30000 кг моногидрата H2SO4. Объем катализатора в установке 0,7 м3. Рассчитать активность катализатора.
Решение. Мерой активности катализатора является изменение скорости химической реакции в результате введения в систему катализатора. Количественно активность катализатора оценивается производительностью катализатора (A k). Под производительностью катализатора подразумевают количество вещества, получающееся в единицу времени с единицы площади поверхности (S k), массы (m k) или объема (V k) катализатора. Производительность катализатора равна
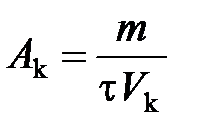 ,
,
где m − масса получаемого вещества; τ − время протекания процесса.
Для определения производительности катализатора выразим время в часах:
A k = 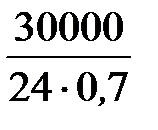 = 1785,7 кг/(м3∙час).
= 1785,7 кг/(м3∙час).
Таким образом, активность ванадиевого катализатора при получении моногидрата H2SO4 равна 1785,7 кг/(м3∙час).
Пример 8.2. Энергия активации некоторой реакции без катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 25 °С?
Решение. Обозначим энергию активации реакции без катализатора через E a, а с катализатором – через E a /, соответствующие константы скорости реакции обозначим через k и k/ . Для решения задачи используем преобразованное уравнение Аррениуса: 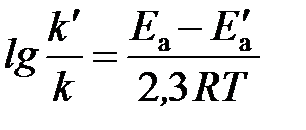 .
.
Подставляя в это уравнение данные задачи, выражая энергию активации в джоулях и учитывая, что Т = 298 К, получим
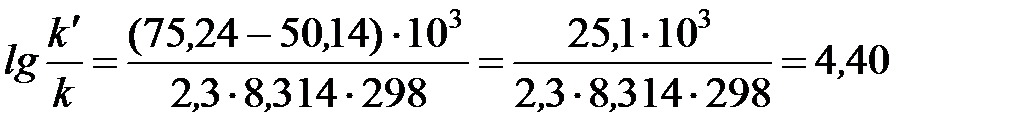 .
.
Окончательно находим k/ / k = 2,5∙104. Таким образом, снижение энергии активации на 25,1 кДж привело к увеличению скорости реакции в 25 тысяч раз.






