Теоретическое введение
Один из методов определения концентрации растворов – объемный анализ. Он сводится к измерению объемов реагирующих веществ, концентрация одного из которых известна.
Такое измерение производится постепенным прибавлением одного раствора к другому до окончания реакции. Этот процесс называется титрованием. Окончание реакции определяется с помощью индикатора.
При определении объемов растворов целесообразно использовать следующие способы выражения концентрации растворов:
Молярная концентрация эквивалентов вещества В или нормальность (с эк (В) или н.) – отношение количества эквивалентов растворенного вещества к объему раствора:
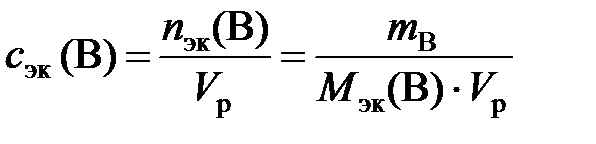 , моль/л,
, моль/л,
где n эк (В) – количество эквивалентов вещества В, моль; m B – масса вещества В, г; М эк (В) – молярная масса эквивалентов вещества В, г/моль; V р – объем раствора, л.
Массовая доля растворенного вещества В (ωВ) – отношение (обычно – процентное) массы растворенного вещества к массе раствора:
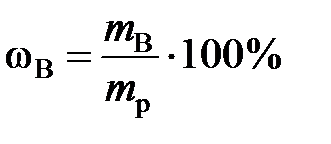 ,
,
где m B – масса вещества В, г; m р – масса раствора, г.
Если выражать массу раствора через его плотность (ρ) и объем (V р), то
 .
.
Титр раствора вещества В (Т В) показывает массу растворенного вещества, содержащуюся в 1 мл (см3) раствора:
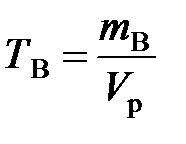 , г/ см3,
, г/ см3,
где m B – масса растворенного вещества В, г; V p – объем раствора, мл.
Титр также можно рассчитать по формуле
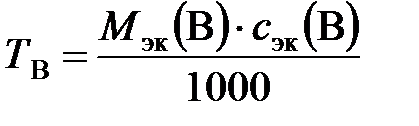 , г/см3,
, г/см3,
где М эк (В) – молярная масса эквивалентов вещества В, г/моль; с эк(В) – молярная концентрация эквивалентов, моль/л.
Примеры решения задач
Пример 10.1. Водный раствор содержит 354 г H3PO4 в 1 л. Плотность раствора ρ = 1,18 г/мл. Вычислить: а) массовую долю (%) H3PO4 в растворе; б) молярную концентрацию; в) молярную концентрацию эквивалентов; г) моляльность;
д) титр; е) молярные доли H3PO4 и Н2О.
Решение. а). Для расчета массовой доли воспользуемся формулой
 ;
; 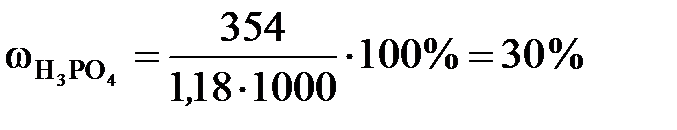 .
.
б). Молярная концентрация вещества В или молярность(с В или М) – отношение количества растворенного вещества к объему раствора:
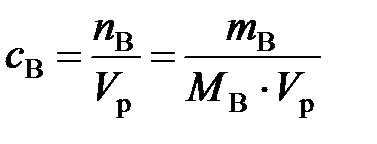 , моль/л, (1)
, моль/л, (1)
где n B – количество вещества В, моль; m B – масса вещества В, г; М В– молярная масса вещества В, г/моль; V р– объем раствора, л.
Молярная масса H3PO4 равна 98 г/моль. Молярную концентрацию раствора находим из соотношения (1):
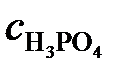 =
= 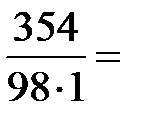 3,61 моль/л.
3,61 моль/л.
в). Молярную концентрацию эквивалентов рассчитываем по формуле 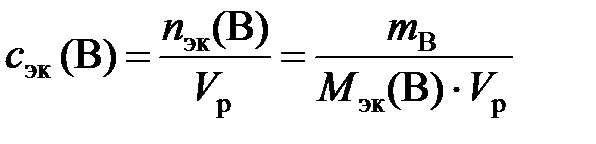 . Молярная масса эквивалентов H3PO4 равна
. Молярная масса эквивалентов H3PO4 равна 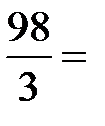 32,7 г/моль.
32,7 г/моль. 
 =
=  10,83 моль/л.
10,83 моль/л.
г). Моляльная концентрация вещества В или моляльность(с m(B)) – отношение количества растворенного вещества к массе растворителя:
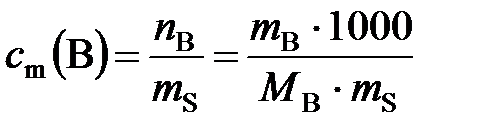 , моль/кг, (2)
, моль/кг, (2)
где n В – количество вещества В, моль; m B – масса вещества В,г; m S – масса растворителя, г; М В − молярная масса вещества В, г/моль.
Для определения моляльности по формуле (2) необходимо рассчитать массу растворителя в растворе. Масса раствора составляет 1,18∙1000 = 1180 г.
Масса растворителя в растворе m S = 1180 – 354 = 826 г.
Моляльная концентрация раствора равна
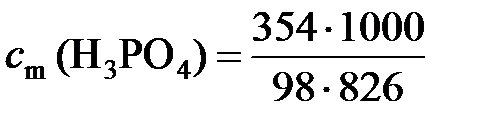 = 4,37 моль/кг.
= 4,37 моль/кг.
д). Титр раствора можно рассчитать по формулам:
 ;
;  =
= 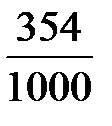 = 0,354 г/ см3,
= 0,354 г/ см3,
 ;
; 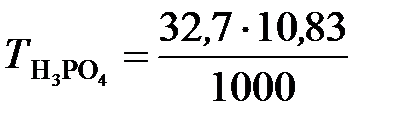 = 0,354 г/ см3,
= 0,354 г/ см3,
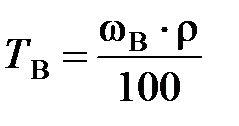 ;
; 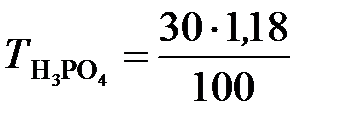 = 0,354 г/ см3.
= 0,354 г/ см3.
е). Молярная (мольная) доля вещества В(х В), безразмерная величина – отношение количества данного вещества к суммарному количеству всех веществ, составляющих раствор, включая растворитель.
Если раствор состоит из одного растворенного вещества и растворителя, то молярная доля вещества (х В) равна
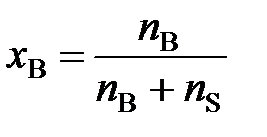 , (3)
, (3)
а молярная доля растворителя (x S)
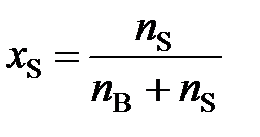 , (4)
, (4)
где n B – количество растворенного вещества, моль; n S – количество вещества растворителя, моль.
Сумма молярных долей всех веществ раствора равна единице.
В 1 л раствора содержится 3,61 моль H3PO4 (см. пункт б). Масса растворителя в растворе 826 г, что составляет 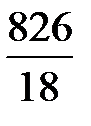 = 45,9 моль.
= 45,9 моль.
Молярные доли H3PO4 и Н2О рассчитываем по формулам (3) и (4):
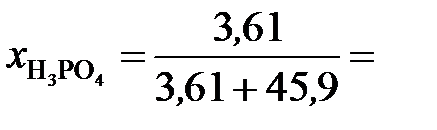 0,073;
0,073;
 0,927.
0,927.
Пример 10. 2. Сколько миллилитров 50 %-го раствора HNO3, плотность которого 1,32 г/мл, требуется для приготовления 5 л 2 %-го раствора, плотность которого 1,01 г/мл?
Решение. При решении задачи пользуемся формулой
 .
.
Сначала находим массу азотной кислоты в 5 л 2 %-го раствора:
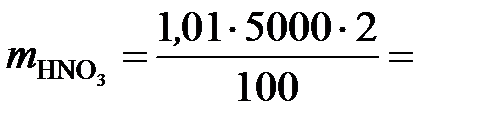 101 г.
101 г.
Чтобы ответить на вопрос задачи, надо определить, в каком объеме раствора с массовой долей HNO3 50 % содержится 101 г HNO3:
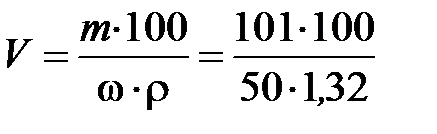 = 153 мл.
= 153 мл.
Таким образом, для приготовления 5 л 2 %-го раствора HNO3 требуется 153 мл 50 %-ного раствора HNO3.
Пример 10. 3. На нейтрализацию 50 мл раствора  кислоты израсходовано 25 мл 0,5 н. раствора щелочи. Чему равна нормальность кислоты?
кислоты израсходовано 25 мл 0,5 н. раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных количествах, то можно написать
V A ∙ н. (А) = V B ∙ н. (B);
50∙н. (кислоты ) = 25∙0,5, отсюда
н. (кислоты) =  0,25 н..
0,25 н..
Следовательно, для реакции был использован 0,25 н. раствор кислоты.






