Теоретическое введение
Скоростью реакции называется изменение концентрации какого-либо из веществ, вступающего в реакцию или образующегося при реакции, за единицу времени.
Скорость химических реакций зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. В общем случае для реакции
nA + mB = pАВ
зависимость скорости реакции от концентрации выражается уравнением
 ,
,
где k – константа скорости реакции; C А и C В – концентрации реагирующих веществ; n и m – коэффициенты перед веществами А и В.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: в гомогенной системе при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2−4 раза: 
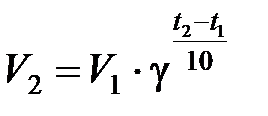 ,
,
где V 2и V 1 – скорость реакции при температурах t 2 и t 1; γ – температурный коэффициент скорости реакции.
Примеры решения задач
Пример 7.1. Как изменится скорость реакции каждой из реакций:
2NO (г) + Cl2 (г) = 2NOCl (г); (1);
СаО (к) + СО2 (г) = СаСО3 (к), (2),
если в каждой системе увеличить давление в 3 раза?
Решение. Реакция (1) гомогенная и, согласно закону действия масс, начальная скорость реакции равна  ; реакция (2) гетерогенная, и ее скорость выражается уравнением
; реакция (2) гетерогенная, и ее скорость выражается уравнением 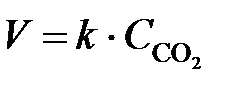 . Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
. Концентрация веществ, находящихся в твердой фазе (в данной реакции СаО), не изменяется в ходе реакции, поэтому не включается в уравнение закона действия масс.
Увеличение давления в каждой из систем в 3 раза приведет к уменьшению объма системы в 3 раза и увеличению концентрации каждого из реагирующих газообразных веществ в 3 раза. При новых концетрациях скорости реакций рассчитываются по формулам:
 (1) и
(1) и  (2).
(2).
Сравнивая выражения для скоростей V и V', находим, что скорость реакции (1) возрастает в 27 раз, а реакции (2) – в 3 раза.
Пример 7.2. Реакция между веществами А и В выражается уравнением
2А + В = D. Начальные концентрации составляют (моль/л): СА = 5, СВ = 3,5. Константа скорости равна 0,4. Вычислить скорость реакции в начальный момент и в тот момент, когда в реакционной смеси останется 60 % вещества А.
Решение. По закону действия масс  . В начальный момент скорость V 1= 0,4×52×3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60 % вещества А, т. е. концентрация вещества А станет равной 5×0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5−3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л.
. В начальный момент скорость V 1= 0,4×52×3,5 = 35. По истечении некоторого времени в реакционной смеси останется 60 % вещества А, т. е. концентрация вещества А станет равной 5×0,6 = 3 моль/л. Значит, концентрация А уменьшилась на 5−3 = 2 моль/л. Так как А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества В уменьшилась на 1 моль и стала равной 3,5 – 1 = 2,5 моль/л.
Следовательно, V 2 = 0,4×32×2,5 = 9.
Пример 7.3. Через некоторое время после начала реакции 2NO + O2 = 2NO2 концентрации веществ составляли (моль/л):  = 0,06;
= 0,06;  = 0,12;
= 0,12;  = 0,216. Найти исходные концентрации NO и O2.
= 0,216. Найти исходные концентрации NO и O2.
Решение. Исходные концентрации NO и O2 находим на основе уравнения реакции, согласно которому на образование 2 моль NO2 расходуется 2 моль NO. По условию задачи образовалось 0,216 моль NO2, на что израсходовалось 0,216 моль NO. Значит, исходная концентрация NO равна
 = 0,06 + 0,216 = 0,276 моль/л.
= 0,06 + 0,216 = 0,276 моль/л.
По уравнению реакции на образование 2 моль NO2 необходимо 1 моль О2, а для получения 0,216 моль NO2 требуется 0,216/2 = 0,108 моль О2. Исходная концентрация О2 равна  = 0,12 + 0,108 = 0,228 моль/л.
= 0,12 + 0,108 = 0,228 моль/л.
Таким образом, исходные концентрации составляли:
 = 0,276 моль/л;
= 0,276 моль/л;  = 0,228 моль/л.
= 0,228 моль/л.
Пример 7.4. При 323 К некоторая реакция заканчивается за 30 с. Определить, как изменится скорость реакции и время ее протекания при 283 К, если температурный коэффициент скорости реакции равен 2.
Решение. По правилу Вант-Гоффа находим, во сколько раз изменится скорость реакции:  .
.
Скорость реакции уменьшается в 16 раз. Скорость реакции и время ее протекания связаны обратно пропорциональной зависимостью. Следовательно, время протекания данной реакции увеличится в 16 раз и составит 30×16 = 480 с = 8 мин.






