Теоретическое введение
Химические реакции сопровождаются выделением или поглощением энергии (чаще всего теплоты). Реакции, протекающие с выделением теплоты, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции. Тепловой эффект химической реакции обычно относят к молю продукта реакции и большей частью выражают в килоджоулях. Тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии системы Δ Н. При экзотермической реакции энтальпия системы уменьшается (Δ Н < 0), а при эндотермической – энтальпия системы увеличивается (Δ Н > 0).
Если исходные вещества и продукты реакции находятся в стандартном состоянии, то в этом случае энтальпию реакции называют стандартной и обозначают Δ Н°.
Определение тепловых эффектов может быть осуществлено опытным путем с помощью калориметра или путем вычислений. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции (т. е. изменение энтальпии Δ Н) зависит только от начального и конечного состояния участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энтальпия реакции nА + mВ → рС + qD
рассчитывается по формуле
Δ Н° х.р. = (рΔ f Н °С + qΔ f Н° D) − (nΔ f Н° А + mΔ f Н° B),
где Δ f Н° – стандартная энтальпия образования вещества, кДж/моль.
Стандартной энтальпией образования вещества называется стандартная энтальпия реакции образования 1 моль данного вещества из простых веществ.
Примеры решения задач
При решении задач этого раздела следует пользоваться табл. Б. 1.
Пример 6.1. Вычислить тепловой эффект и написать термохимическое уравнение реакции горения ацетилена, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 10 л ацетилена при нормальных условиях?
Решение. Реакция горения ацетилена протекает по уравнению
С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г).
Пользуясь следствием из закона Гесса и справочными данными из табл. Б.1, вычисляем тепловой эффект реакции:
 ,
,
D H° х.р. = [2(–393,5) + (–241,8)] − [226,8 + 5½∙0] = –1255,6 кДж.
Термохимическими называются уравнения химических реакций, в которых указано изменение энтальпии. Изменение энтальпии (тепловой эффект) записывают в правой части уравнения после запятой.
Термохимическое уравнение реакции горения ацетилена имеет вид:
С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г), D H° х.р.= –1255,6 кДж.
Тепловой эффект обычно относят к одному молю вещества. Следовательно, при сжигании 1 моль С2Н2 выделяется 1255,6 кДж. Однако по условию задачи сжигается 10 л ацетилена, что составляет 10/22,4 = 0,446 моль С2Н2, где 22,4 л/моль – мольный объем любого газа при нормальных условиях. Таким образом, при сгорании 0,446 моль (10 л) С2Н2 выделится 0,446×(1255,6) = 560 кДж теплоты.
Пример 6.2. Реакция идет по уравнению Fe2O3 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к).
При восстановлении 48 г Fe2O3 выделяется 256,1 кДж теплоты. Вычислить тепловой эффект реакции и стандартную энтальпию образования Fe2O3.
Решение. Число молей Fe2O3, содержащихся в 48 г Fe2O3, составляет 48/160 = 0,3 моль, где 160 г/моль – молярная масса Fe2O3. Так как тепловой эффект относят к 1 моль вещества, то тепловой эффект данной реакции равен –256,1/0,3 =
= –853,7 кДж. Запишем термохимическое уравнение этой реакции:
Fe2O3 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к), D H° х.р. = –853,8 кДж.
Формула для расчета теплового эффекта данной реакции имеет вид:
 , отсюда находим
, отсюда находим  :
:  .
.
После подстановки справочных данных из табл. Б. 1 получаем:
 = 2×0 – 1676 – 2×0 + 853,8 = –822,2 кДж/моль.
= 2×0 – 1676 – 2×0 + 853,8 = –822,2 кДж/моль.
Таким образом, тепловой эффект реакции равен –853,8 кДж, а  составляет –822,2 кДж/моль.
составляет –822,2 кДж/моль.
Пример 6.3. Исходя из термохимических уравнений:
Н2 (г) + О2 (г) = Н2О2 (ж), Δ Н° (1) = –187 кДж; (1)
Н2О2 (ж) + Н2 (г) = 2Н2О (г), Δ Н° (2) = –297 кДж; (2)
Н2О (г) = Н2О (ж), Δ Н° (3) = – 44 кДж, (3)
рассчитать значение стандартной энтальпии реакции образования Н2О (ж).
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить:
Н2 (г) + ½О2 (г) = Н2О (ж), Δ Н° (4)–?(4)
В уравнения (1), (2), (3) входят Н2О2 (ж) и Н2О (г), которые не входят в уравнение (4). Чтобы исключить их из уравнений (1), (2), (3), умножим уравнение (3) на 2 и сложим все три уравнения:
Н2 (г) + О2 (г) + Н2О2 (ж) + Н2 (г) + 2Н2О (г) = Н2О2 (ж) + 2Н2О (г) + 2Н2О (ж). (5)
После преобразования уравнения (5) и деления его на 2 получаем искомое уравнение (4). Аналогичные действия проделаем с тепловыми эффектами:
 .
.
В результате получаем  кДж,
кДж,
т. е. энтальпия образования Н2О (ж):  = –286 кДж/моль.
= –286 кДж/моль.
Пример 6.4. В каком направлении будет протекать при стандартных условиях реакция СН4 (г) + СО2 (г) ↔ 2СО (г) + 2Н2 (г)?
Решение. Направление протекания химической реакции определяет энергия Гиббса (∆ G). Изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Формула для расчета изменение энергии Гиббса изучаемой реакции имеет вид
 .
.
Значения Δ f G° берем из табл. Б. 1 и получаем
Δ f G° = [2∙(–137,1) + 2∙0] − [(–50,8) + (–394,4)] = +171 кДж.
При р = const, T = const реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆ G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆ G > 0, то самопроизвольное протекание процесса в прямом направлении невозможно. Если ∆ G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Так как ∆ G° х.р. = +171 кДж, т.е. ∆ G > 0, то самопроизвольное протекание данной реакции в прямом направлении в стандартных условиях невозможно.
Пример 6.5. Определить изменение энтропии в стандартных условиях для реакции, протекающей по уравнению
С (графит) + 2Н2 (г) = СН4 (г).
Решение. Изменение энтропии системы в результате протекания химической реакции (∆ S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов:
 .
.
Подставляем в формулу справочные данные из табл. Б. 1 и получаем:
∆ S° х.р. = 186,2 − (5,7 + 2∙130,6) = –80,7 Дж/К.
Пример 6.6. По значениям стандартных энтальпий образования и стандартных энтропий веществ, участвующих в реакции, вычислить изменение энергии Гиббса реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г).
Решение. Изменение энергии Гиббса в химической реакции при температуре Т можно вычислить по уравнению
∆ G° х.р. = ∆ Н° х.р. – Т ∆ S° х.р..
Тепловой эффект реакции ∆ Н° х.р. и изменение энтропии ∆ S° х.р. определяем по следствию из закона Гесса:
 ;
;
 .
.
Используя справочные данные табл. Б. 1, получаем:
∆ Н° х.р. = [(–393,5) + 0] − [(–110,5) + (–285,8)] = +2,8 кДж;
∆ S° х.р. = (213,7 + 130,6) − (197,5 + 70,1) = +76,7 Дж/К.
Изменение энергии Гиббса в химической реакции:
∆ G° х.р. = ∆ Н° х.р. – Т ∆ S° х.р.; Т = 298 К;
∆ G° х.р. = 2,8 − 298∙76,7∙10-3 = –20,05 кДж.
Пример 6.7. Определить температуру, при которой установится равновесие в системе
СаСО3 (к) 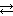 СаО (к) + СО2 (г).
СаО (к) + СО2 (г).
Решение. При химическом взаимодействии одновременно изменяется энтальпия, характеризующая стремление системы к порядку, и энтропия, характеризующая стремление системы к беспорядку. Если тенденции к порядку и беспорядку в системе одинаковы, то ∆ H° х.р. = Т ∆ S° х.р., что является условием равновесного состояния системы. Отсюда можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
 .
.
Сначала вычисляем ∆ Н° х.р. и ∆ S° х.р.по формулам:
 ;
;
 .
.
Используя справочные данные табл. Б. 1 получаем:
D H °х.р.= [– 635,5 + (–393,5)] – (–1207,1) = 178,1 кДж;
D S °х.р. = (39,7 + 213,7) – 92,9 = 160,5 Дж/К или 0,1605 кДж/К.
Отсюда температура, при которой устанавливается равновесие:
Т равн. = 178,1/0,1605 = 1109,5 К.
Пример 6.8. ВычислитьD H° х.р., ∆ S° х.р. и D G°T реакции, протекающей по уравнению Fe2O3 (к) + 3C (к) = 2Fe (к) + 3CO (г). Возможна ли реакция
восстановления Fe2O3 углеродом при температуре 298 и 1000 К?
Решение. Вычисляем D H° х.р. и D S° х.р.:
 ,
,
D H°х.р. =[3(–110,5) + 2·0] – [–822,2 + 3·0] = –331,5 + 822,2 = +490,7 кДж;
 ,
,
D S° х.р. = (2·27,2 + 3·197,5) – (89,9 + 3·5,7) = 539,9 Дж/К или 0,540 кДж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения D G° х.р. = D H°х.р. – Т D S°х.р..
D G° 298 = 490,7 – 298×0,540 = +329,8 кДж;
D G° 1000 = 490,7 – 1000×0,540 = –49,3 кДж.
Так как D G° 298 > 0, а D G° 1000< 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 298 К.






