С этими способами описания систем Вы уже знакомы из курсов физики и математической статистики. Здесь мы лишь напомним основные законы и рассмотрим их особенности в применении к нашим задачам.
При термодинамическом подходе к описанию свойств коллектива, состоящего из огромного числа частиц, его рассматривают как макроскопическую систему, не интересуясь природой тех частиц, из которых он состоит. Такую систему называют термодинамической. Это основное понятие термодинамического подхода.
По возможности обмена с окружающей средой энергией и веществом различают открытые, закрытые и изолированные системы.
В частности, изолированная система, по определению, не обменивается с окружающей средой ни энергией, ни веществом. Приблизительным аналогом такой системы является закрытый термос в определенный момент времени. Понятно, что самый хороший термос теряет тепло за продолжительный период. Открытая система, подобно стакану с кипятком, обменивается и энергией, и веществом (пар) с окружающей средой. Промежуточный вариант – закрытый стакан с кипятком – может служить иллюстрацией закрытой системы. Вода в нем остывает, но пар из него не выходит.
Изолированная система может находится в состоянии, которое называют равновесным. Такое состояние замечательно тем, что может продолжаться сколь угодно долго. Тогда состояние системы однозначно определяется параметрами системы, такими как давление, температура, плотность заряда. Выбор параметров зависит от свойств системы. Кроме того, если система включает подсистемы, например, области с различными носителями заряда, необходимо задать концентрацию этих зарядов. Такие системы называют гетерогенными (в отличие от гомогенных).
Всякое изменение в термодинамической системе, связанное с изменением хотя бы одного параметра состояния, вызовет термодинамический процесс. Так, разность температур обусловливает теплопередачу, разность концентраций электрических зарядов – электрический ток.
Термодинамическое описание основано на двух законах термодинамики, которые подтверждаются опытом человечества.
Первый закон термодинамики, или закон сохранения энергии, говорит о постоянстве внутренней энергии изолированной системы. Эта энергия является функцией состояния системы, т.е. не зависит от пути перехода системы в это состояние. Изменение внутренней энергии системы dU происходит в результате прихода или отдач тепла δQ и совершения работы δA системой или над ней
dU = δQ + δA. (3.1)
Теплота и работа не являются функциями состояния системы, т.к. зависят от пути перехода, поэтому их изменения определяются не дифференциалом, как для энергии, а изменением. Знак работы и теплоты зависит от того, куда направлен процесс: внутрь системы или из нее. Характер работы определяется характером системы: механическая работа, работа электрических или других сил.
Второй закон термодинамики вводит новую функцию для описания системы – энтропию S. Математически энтропию можно представить как
Δ S =Δ Q / T (3.2)
или
 , (3.3)
, (3.3)
где подынтегральная функция называется элементарной приведенной теплотой в равновесном процессе.
Если в термодинамической системе совершается какой-либо процесс, то первое начало термодинамики ответит на вопрос о соотношении энергии, теплоты и работы, но не сможет дать ответ на вопрос, каково направление протекания этого процесса. На этот, зачастую очень важный, вопрос отвечает второй закон термодинамики, который говорит о невозможности убывания энтропии в изолированной системе, т.е.
dS ≥ 0. (3.4)
Иначе говоря, энтропия необратимых процессов в системе возрастает, а энтропия обратимых процессов неизменна. Напомним, что к обратимым процессам относится цепь равновесных состояний. Следовательно, можно говорить о том, что равновесному состоянию термодинамической системы соответствует максимальное значение энтропии. С учетом вышесказанного, для системы, совершающей работу расширения, выражение (3.1) можно представить в виде:
dU = TdS - PdV, (3.5)
где P – давление в системе;
dV – приращение ее объема.
Пусть мы имеем гетерогенную систему, о которой говорилось выше, и в системе происходит обмен частицами между фазами (подсистемами). Тогда в последнее выражение необходимо добавить член, описывающий этот процесс, и записать для каждой фазы
dU = TdS - PdV + μdN, (3.6)
где μ – химический потенциал фазы;
dN – изменение числа частиц.
Если система находится в равновесии, то dS = dV =0 и можно записать
 . (3.7)
. (3.7)
Очевидно, химический потенциал выражает изменение внутренней энергии системы при изменении числа ее частиц на единицу в условиях постоянства объема и энтропии системы, т.е. в условиях равновесия.
Рассмотрим условие равновесия для гетерогенной системы, общее число частиц которой остается постоянным, но где частицы могут переходить из одной фазы в другую. Примером такой системы может служить кусок льда в воде или два различных металла, находящиеся в контакте. И в первом, и во втором случаях происходит переход частиц из одной среды в другую. В случае равновесия в системе (U =const), dN 1= dN 2, т.е. число частиц каждой фазы не изменяется. Тогда можно записать условие равновесия на границе фаз. Чтобы ни одна фаза не росла за счет другой, необходимо выполнение условия:
μ 1= μ 2. (3.8)
Это очень важное условие, и впоследствии мы им будем пользоваться не раз.
Если гетерогенная система многофазна, то для равновесия на каждой из границ должно выполняться условие (3.8).
Другим методом описания свойств коллектива состоящего из большого числа частиц, является статистический метод. Как следует из статистическойфизики, коллектив, состоящий из большого числа частиц, является системой, качественно отличной от системы из нескольких частиц. Его поведение подчиняется иным закономерностям, которые называются статистическими. Для иллюстрации характера этих закономерностей обычно приводят следующие примеры.
Координата отдельной молекулы газа в объеме – величина случайная, поскольку тепловое движение хаотично. Однако, если таких частиц много, то можно с уверенностью говорить о равенстве числа частиц в равных частях этого объема. Если же таких частиц всего несколько, то всегда найдется область, в которой их совсем нет.
Скорость отдельной молекулы этого газа есть величина случайная, и определить ее заранее невозможно, но если коллектив состоит из большого числа частиц, то существует четкое распределение их по скоростям. Можно определить, какая доля молекул обладает скоростями в интервале 100–200 м/с, а какая доля – в интервале 200–250 м/с и т.д.
Такого рода закономерности и называют статистическими.
Основной особенностью статистических закономерностей является их вероятностный характер. Они позволяют предсказывать вероятность наступления того или иного состояния. И вероятность будет тем больше, чем больше число испытаний или членов коллектива. Это положение подтверждается соотношением, полученным в статистической физике:
 , (3.9)
, (3.9)
где  – средняя физическая величина (например, число частиц в энергетическом интервале);
– средняя физическая величина (например, число частиц в энергетическом интервале);
Δ А – отклонение наблюдаемой величины;
N – число частиц.
Из последнего выражения видно, что с увеличением числа частиц физическая величина испытывает все меньшие отклонения, т.е. стремится к своему среднему значению. Так, если в 1 мм3 полупроводника (чип) содержится 1011 электронов, то относительное отклонение  составит 3·10-4%, а это достаточно мало.
составит 3·10-4%, а это достаточно мало.
Для больших коллективов в статистической физике принято связь между параметрами частицы (импульс, энергия) и термодинамическими параметрами коллектива осуществлять с помощью статистической функции распределения. В качестве параметров коллектива удобно использовать температуру и химический потенциал. Аргументами функции распределения являются координаты и проекции импульса.
Полной статистической функцией распределения называют функцию
N (E) dE = f (E) g (E) dE, (3.10)
где N (E) dE – число частиц в интервале энергии от E до E + dE;
f (E) – среднее число частиц в данном интервале, найденное путем усреднения по многим одинаковым состояниям;
g (E) dE – число энергетических состояний в данном интервале.
Функцию f (E) обычно называют просто функцией распределения в отличие от полной функции распределения (3.10). Вид функции распределения зависит от свойств частиц, составляющих коллектив, и может изменяться с изменением параметров системы. Для расчета (3.10) необходимо определить конкретный вид f (E).
Число состояний включает g (E) – плотность состояний. Конкретный вид функции g (E) необходим и для решения уравнения (3.10), а также для решения частных случаев (3.10), например, поиска концентрации носителей в полупроводнике, теплоемкости твердого тела, энергии теплового излучения и т.д.
3.2. Фермионы и бозоны. Вырожденные и невырожденные
коллективы
Как мы уже отмечали, вид функции распределения зависит от особенностей поведения частиц, составляющих коллектив. Все микрочастицы, которые нам встретятся, по характеру поведения можно разделить на две группы: классические и квантовые (рис. 3.1).

Рис. 3.1. Классификация микрочастиц
В свою очередь квантовые частицы можно разделить на фермионы и бозоны.
К классическим частицам можно отнести молекулы идеального газа. Они подчиняются функции распределения Максвелла-Больцмана.
Фермионы – микрочастицы, обладающие полуцелым спином  , ħ /2, 3 ħ /2... Это электроны, протоны, нейтроны и т.д. К фермионам также относятся ядра, суммарный спин которых является полуцелым. Основной характерной особенностью фермионов является то, что именно к ним (а не только к электронам) применим постулат запрета Паули (п. 2.7). Фермионы подчиняются функции распределения Ферми-Дирака, чему и обязаны своим названием.
, ħ /2, 3 ħ /2... Это электроны, протоны, нейтроны и т.д. К фермионам также относятся ядра, суммарный спин которых является полуцелым. Основной характерной особенностью фермионов является то, что именно к ним (а не только к электронам) применим постулат запрета Паули (п. 2.7). Фермионы подчиняются функции распределения Ферми-Дирака, чему и обязаны своим названием.
К бозонам принадлежат частицы с целочисленным или нулевым спином: 0, ħ, 2 ħ... Это фотоны, фононы, мезоны. На них не только не действует постулат Паули, но чем больше частиц на энергетическом уровне, тем больше вероятность его заселения. Бозоны подчиняются функции распределения Бозе-Эйнштейна.
Особенности квантовых частиц могут влиять на свойства коллектива. Для того чтобы это влияние стало определяющим для коллектива, необходима достаточно высокая плотность частиц в энергетическом пространстве, т.е. вероятность занимать одно или близкие энергетические состояния.
Предположим, что в системе имеется G различных энергетических состояний и N частиц. Мерой энергетической плотности частиц может служить отношение N / G. Микрочастицы не будут влиять друг на друга, если
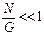 . (3.11)
. (3.11)
В этом случае число вакантных состояний будет много больше числа микрочастиц: G >> N. В таких условиях особенности фермионов и бозонов не проявляются, поскольку не возникает вопрос о заселении одного состояния несколькими частицами. Такие коллективы называют невырожденными, а неравенство (3.11) – условием невырожденности.
Если же число состояний G имеет один порядок с числом частиц N, т.е. если выполняется условие
 , (3.12)
, (3.12)
то вопрос о заселении энергетических состояний становится актуальным. В этом случае “характер” частиц проявляется и оказывает значительное влияние на свойства коллектива. Такие коллективы относят к вырожденным, а условие (3.12) называют условием вырождения.
Понятно, что вопрос о степени вырождения коллектива возникает только в том случае, когда коллектив состоит из квантовомеханических объектов. Параметры таких частиц меняются дискретно (см., например, п. 2.7), и число состояний является ограниченным.
Вспомним, что число состояний есть функция параметров системы, т.е. является величиной переменной. Во многих системах число частиц также может изменяться (например, число электронов в полупроводнике при изменении температуры). Из сказанного следует, что вырожденность не есть категория неизменная и при изменении условий, например, температуры, возможен переход из вырожденного состояния в невырожденное или обратно. Коллектив, состоящий из классических объектов, может находиться только в невырожденном состоянии, поскольку число энергетических уровней здесь не ограничено (табл. 3.1).
Таблица 3.1
Возможные варианты состояний
| Объекты | Коллективы | |
| вырожденный | невырожденный | |
| Классические | Нет | Да |
| Квантовые | Да | Да |
Для решения задачи с полной функцией распределения (3.10) необходимо определить плотность или число состояний.
Эта задача решается в предположении о минимальной ячейке в, так называемом, фазовом пространстве.
Под фазовым пространством понимают шестимерное пространство, где кроме геометрических координат частицу характеризуют составляющие импульса pх, py, pz. В таком пространстве координаты отображают не только геометрическое, но и энергетическое состояние частицы.
Если частица обладает волновыми свойствами и подчиняется соотношениям Гейзенберга, то в фазовом пространстве для нее существует минимальный объем, равный h 3. Опуская математические выкладки, приведем решение задачи для числа состояний в фазовом пространстве:
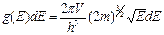 , (3.13)
, (3.13)
где V – геометрический объем.
Это и есть число состояний микрочастицы в интервале от Е до E + dE. Из выражения (3.13) следует, что плотность состояний в энергетическом интервале описывается функцией
 . (3.14)
. (3.14)
Согласно постулату Паули, в минимальной энергетической ячейке возможно существование двух фермионов с различными спинами. Тогда правые части (3.13) и (3.14) в случае микрочастиц-фермионов (например, электронов) необходимо удвоить.






