Основные понятия
Методы окислительно-восстановительного (ОВ) титрования или red-ox-методы – это титриметрические методы, основанные на использовании окислительно-восстановительных реакций.
Обычно их классифицируют следующим образом.
1.По характеру титранта:
•оксидиметрические – методы определения восстановителей с применением титранта-окислителя;
• редуктометрические – методы определения окислителя с применением титранта-восстановителя.
2. По природе реагента (титранта), взаимодействующего с определённым веществом:
• KMnO4 – перманганатометрия;
• Na2S2O3, KI, – йодометрия;
• I2 – йодиметрия.
Основные понятия:
•окислитель – частица (вещество), принимающее электроны;
•восстановитель - частица (вещество), отдающее электроны.
Fe2+ + Ce4+ = Fe3+ + Ce3+
Ce4+ - окислитель
Fe2+ - восстановитель
Каждую ОВР можно представить состоящей из двух полуреакций:
Ce4+ + 1е → Ce3+
Fe2+ - 1е → Fe3+
Fe2+ + Ce4+ = Fe3+ + Ce3+- уравнение электронного баланса
Oкисление Fe2+ перманганатом калия в Н+ среде:
МnO4- + 5e +8 Н+ = Mn2+ + 4H2O1
Fe2+-1e =Fe3+ 5
MnO4- + 5Fe2+ + 8Н+ = Mn2++5Fe3+ +4H2O.
Окислительно-восстановительные потенциалы
Компоненты каждой полуреакции можно поместить в разные сосуды и соединить солевым мостиком (полоской фильтровальной бумаги, смоченной раствором KCl, или стеклянной трубкой, заполненнойKCl).Если в каждый сосуд опустить инертные электроды (Pt) и замкнуть их на гальванометр или подключить к потенциометру, то прибор покажет наличие тока. Во внешней цепи через Pt проволочки в гальванометр будут переходитьэлектроны от Fe2+ к Ce4+ и начнется реакция. Через некоторое время в сосуде с Fe2+ можно будет обнаружить ионы Fe3+как результат реакции.
Э.Д.С. гальванического элемента замеряют с помощью потенциометра. Численно величина ЭДС равна:
Э.Д.С. = Е1 – Е2, (17)
где Е1 – потенциал окислителя, Е2 – потенциал восстановителя.
Каждый электрод представляет собой систему из окисленной и восстановленной форм данного вещества (редокс-систему). Эту систему называют редокс-парой. Например:
Fe3+/Fe2+, Ce4+/Ce3+, MnO4-/Mn2+.
Потенциал отдельной окислительно-восстановительной пары измерить невозможно. Используют относительные характеристики пар - относительно стандартного водородного электрода.
Стандартный водородный электрод – это электрод из платинированной Pt, омываемый газообразным водородом при р = 1,013 105 Па (1 атм) и погруженный в раствор кислоты с активностью ионов Н+, а = 1.Платинированная платина поглощает Н2, и электрод действует так, как будто он состоит из газообразного Н2, находящегося в равновесии с ионами Н+ в растворе:
Н2(г) = 2Н+ + 2е
Потенциал стандартного электрода принят равным 0 при всех температурах.
Следовательно, в уравнении Э.Д.С., если Е2 = 0, то Э.Д.С. = Е1.
Таким образом, потенциал данного электрода – это Э.Д.С. элемента, состоящего из данного и стандартного электрода.
Зависимость окислительно-восстановительного потенциала Е от концентрации и температуры описывается уравнением Нернста.
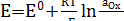 , (18)
, (18)
где, Е0 – стандартный окислительно-восстановительный потенциал; R –универсальная газовая const, равная 8,312 Дж/моль К; Т – абсолютная температура, К; F – const Фарадея, равная 96485 Кл; n – число электронов, принимающих участие в электродном процессе; aOx, аRed – активности окисленной и восстановленной форм вещества.
Электродный потенциал также показывает, в какой степени концентрации в электрохимической цепи отличаются от равновесных. В случае обратимойполуреакции:
аА + вВ + nе↔сС + dD
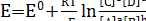 . (19)
. (19)
Таким образом, окислительно-восстановительным потенциалом называется потенциал системы, в которой все участники полуреакции находятся в стандартном состоянии, а растворенное вещество – в стандартном растворе.
При 250Суравнение (18) примет вид:
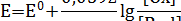
Пример 1.
МnO4- + 5e +8Н+ = Mn2+ + 4H2O
Для этой полуреакции уравнение Нернста имеет вид:
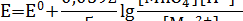
Электродный формальный потенциал (Е1) характеризует систему, в которой концентрации всех участников (а не активности) равны 1 моль/л.
Схема электрохимической цепи:
Сu | CuSO4(1M) || AgNO3 (1M) | Ag
Cu| Cu2+ (1M) || Ag+ (1M) | Ag
Потенциал электрохимической цепи Е = Екатод–Еанод.
Отрицательный потенциал цепи показывает, что цепь электролитическая, положительный – цепь гальваническая.
По величинам стандартных ред-окс потенциалов можно определить ЭДС ОВР и направление ее самопроизвольного протекания. Если ЭДС = Е0окисл - Е0восст >0 то реакция протекает в прямом направлении, если < 0, то реакция протекает в обратном направлении.
Всегда системы с более высоким стандартным окислительно-восстановительным потенциалом будут окислять системы с более низким потенциалом.






