Термодинамика изучает переходы энергии из одной формы в другую, энергетические эффекты, которыми сопровождаются химические и физические процессы, зависимость этих эффектов от условий процесса, возможность самопроизвольного протекания процессов, их направление и условия равновесия.
Объектом изучения в термодинамике является система. Системой называют совокупность находящихся во взаимодействии веществ, обособленных от окружающей среды.
Для описания систем используют набор термодинамических функций, основными из которых являются Н – энтальпия, S – энтропия, G – энергия Гиббса.
Энтальпия – сложная термодинамическая функция, определяющая энергию, необходимую для приведения данной системы в данное состояние, и при этом учитывающая изменение внутренней энергии и совершаемую работу
(H = U + PV).
Однако для системы представляет интерес D H х.р. – изменение энтальпии в ходе химической реакции или тепловой эффект реакции, если Р, Т = const.
Энтальпийный эффект химической реакции определяют по закону Гесса и следствию из него. Следствие из закона Гесса:
· Изменение энтальпии химической реакции равно разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
 = å(n ×
= å(n × 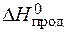 ) – å (m ×
) – å (m × 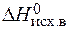 ),
),
где n, m – стехиометрические коэффициенты.
В справочных таблицах приводят стандартные энтальпии образования веществ ( , кДж/моль (табл. П.2). Стандартные условия: Т = 298 К, р = 1,013×105 Па, вещества – химически чистые и имеют концентрацию 1 моль/л ([A] = 1 моль/л). Энтальпия образования простых веществ, находящихся в устойчивой аллотропной форме (N2, O2, Cl2, H2 и др.) = 0.
, кДж/моль (табл. П.2). Стандартные условия: Т = 298 К, р = 1,013×105 Па, вещества – химически чистые и имеют концентрацию 1 моль/л ([A] = 1 моль/л). Энтальпия образования простых веществ, находящихся в устойчивой аллотропной форме (N2, O2, Cl2, H2 и др.) = 0.
Различают реакции:
· Экзотермические – протекают с выделением тепла (D H 0х.р . < 0).
· Эндотермические – протекают с поглощением тепла (D H 0х.р. > 0).
Уравнения реакций, в которых указан тепловой эффект называют термохимическими.
Энтропия является количественной мерой неупорядоченности системы. Значение энтропии для любого вещества можно определить экспериментально. Энтропия зависит от природы веществ, агрегатного состояния, давления, температуры. В таблицах термодинамических величин (см. приложение) приводят значения стандартных энтропий веществ S0298. Следует отметить, что энтропия простых веществ не равна нулю.
Изменение энтропии в ходе химической реакции D S0 298 может быть рассчитано так же, как и для любой другой функции состояния, по следствию из закона Гесса:
D S0х.р. = å n S0прод. – å m S0исх . × 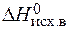 ),
),
где n, m – стехиометрические коэффициенты.
Самопроизвольно, т.е. без затраты работы извне, система может переходить только из менее устойчивого состояния в более устойчивое. В химических процессах одновременно действуют две тенденции:
· стремление частиц объединяться за счет прочных связей в более сложные, что сопровождается уменьшением энтальпии;
· стремление частиц разъединяться, что увеличивает беспорядок, т.е. энтропию.
Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (D H 0) и энтропийного (Т D S0). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при р, Т = const, отражает изменение энергии Гиббса G:
D G = D H 0– Т ×D S0
Изменение энергии Гиббса может быть вычислено так же по следствию из закона Гесса:
D G0х.р. = å n D G0 прод. – å m D G0исх..,
где n, m – стехиометрические коэффициенты.
Энергия Гиббса образования простых веществ равна нулю.
Изменение энергии Гиббса характеризует возможность и направление самопроизвольного протекания химической реакции:
· D G0 < 0– реакция самопроизвольно протекает в прямом направлении;
· D G0 > 0– самопроизвольно протекает обратная реакция;
· D G0 = 0 – система находится в состоянии химического равновесия.
Химическое равновесие
Самопроизвольно протекающие реакции можно разделить на два вида:
· практические необратимые реакции – идут в одном направлении, до полного расходования одного или всех реагирующих веществ:
CH4+2O2 = CO2+2H2O
· обратимые реакции – протекают одновременно в двух взаимно противоположных направлениях:
H2 + I2 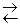 2HI
2HI
2SO2 + O2 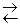 2SO3
2SO3
В результате обратимого процесса в системе устанавливается химическое равновесие.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.

В состоянии химического равновесия концентрации всех участников реакции постоянны и не изменяются со временем, хотя прямая и обратная реакции не прекращаются. Концентрации веществ (моль/л) в состоянии химического равновесия принято называть равновесными.






