Мета роботи. Дослідити рівновагу реакції  за сталої температури (в інтервалі 350 - 500°С), експериментально визначити константу рівноваги реакції й порівняти її із значенням, розрахованим за допомогою термодинамічних методів.
за сталої температури (в інтервалі 350 - 500°С), експериментально визначити константу рівноваги реакції й порівняти її із значенням, розрахованим за допомогою термодинамічних методів.
Методика роботи. Константа рівноваги означеної реакції записується як
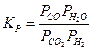 (1)
(1)
Якщо вихідна газова суміш містить а1 молів СО і b1 молів Н2 та після встановлення рівноваги ступінь перетворення діоксиду вуглецю дорівнює α, то рівноважна газова суміш має такий склад:
діоксид вуглецю, СО2 – а1(1 - α), моль
водень, Н2 – b1 – а1 • α, моль
водяна пара, H2O – а1 • α, моль
оксид вуглецю, СО – а1 • α, моль.
Загальна кількість молів у ході реакції не змінюється і дорівнює а1 + b1. З цієї ж саме причини константи рівноваги КР, КN і КС дорівнюють одна одній, отже, будь-яку з них, зокрема і КР, можна виражати як через парціальні тиски, так і через мольні частки, або навіть через кількості молів реагентів, що містяться в певному об'ємі рівноважної газової суміші. Отже, замість рівняння (1) можна записати:
 . (2)
. (2)
Ступінь перетворення діоксиду вуглецю визначається шляхом аналізу вихідної й рівноважної газової суміші на вміст СО2 розраховується за формулою:
 , (3)
, (3)
де а1 і а2 - вміст діоксиду вуглецю в рівних за об'ємом вихідній і рівноважній газових сумішах відповідно. Співвідношення кількостей водню і діоксиду вуглецю у вихідній суміші визначається співвідношенням швидкостей, з якими ці гази надходять у реактор
 . (4)
. (4)
Схему пристрою для вивчення рівноваги реакції наведено на рис.1.
Вуглекислий газ надходить з балона 1 через вентиль 2 і редуктор 3. Водень одержують електролітично в електролізері 27, що живиться від випрямляча 28. Швидкості кожного з газів стабілізують за допомогою маностатів 4 і 25, пропускають через осушуючі склянки 7 та 24, регулюють за допомогою кранів 9 і 17 і вимірюють реометрами 8 і 20. Вихідна суміш газів (Н2 + СО2) через триходовий кран 16 надходить у реактор 18, заповнений каталізатором (хромонікелевим).
Необхідна в реакторі температура забезпечується за допомогою електропечі і встановлюється шляхом підбору відповідної напруги трансформатором 19 та вимірюється термопарою, гарячий пай якої знаходиться в реакторі. Термопару приєднано до вимірювального приладу 21.
З реактора газова суміш виходить через вузький капіляр, що забезпечує швидке її охолодження і заморожування того складу, що був рівноважним за більш високої температури в реакторі. Далі через триходові крани 13 і 14 газ надходить на аналіз у поглинальні склянки 12, заповнені розчином Ва(ОН)2. Вихідна газова суміш на аналіз подасться через триходові крани 14 і 16 поза реактором.
Порядок роботи.
1. Перед початком роботи слід перевірити пристрій на герметичність. Для цього через пристрій починають пропускати водень і вуглекислий газ з довільною швидкістю.
Газ має проходити через реактор 18 і поглинальні склянки 12. Температура в реакторі під час перевірки на герметичність не повинна змінюватись. Потім гумову трубку після промивних склянок 12 перетискують. Ознакою герметичності є відсутність пробулькування газу в промивних склянках, а також показання реометрами нульової швидкості. Гази при цьому надходять в атмосферу через маностати 4 і 25.

|
| Рис. 1. Схема пристрою для дослідження хімічної рівноваги в реакції між діоксидом вуглецю і воднем (пояснення в тексті) |
2. Калібрування реометрів виконується заздалегідь. Будуються калібрувальні графіки в координатах "швидкість газу U (мл/хв) - різниця рівнів рідини в колінах реометра Δh (мм)". Під час калібрування реометра 8 за вуглекислим газом подача водню через пристрій перекривається краном 17. Вуглекислий газ пропускається через крани 14 і 16 поза реактором - через кран 13, промивні склянки 12 і посудину Бойля-Маріотта 22[2]. Конструкція посудини Бойля-Маріотта забезпечує рівність об'ємів газу, що надходить до неї, та рідини, що з неї витікає, незалежно від кількості рідини у посудині. Перед початком вимірювань за допомогою крана 9 встановлюється певна різниця рівнів Δh рідини в реометрі 8 і вичікується деякий час для встановлення стаціонарності протікання газу. Потім визначається швидкість його протікання шляхом вимірювання об'єму рідини, що збирається в циліндрі 23 за час, точно встановлений за секундоміром. Такі визначення виконуються за різних Δh, після чого будується вказаний вище графік. Калібрування реометра 20 за воднем проводиться аналогічно. Кран 9 при цьому повинен бути закритим, а регулювання швидкості газу здійснюють за допомогою крана 17.
3. Аналіз вихідної й рівноважної газових сумішей проводять на вміст СO2. З цією метою в першому випадку газ на аналіз подають через крани 14 і 16 поза реактором, у другому випадку - через реактор, де встановлено задану температуру. Аналіз здійснюють шляхом поглинання СО2 титрованим розчином Ва(ОН)2, відомі кількості якого (по 50 мл) залиті в поглинальні склянки 12. Кількість поглинутого СО2 визначають за різницею об'ємів розчину соляної кислоти, витраченої на нейтралізацію однакової кількості розчину Ва(ОН)2 до пропускання через нього газової суміші й після цього.
4. Послідовність здійснення операцій при вмиканні пристрою та проведення експерименту:
4.1. Підняти склянку 5, працюючи кранами 6, 10, 26 і 30, заповнити маностат 4, набрати невеликі кількості води в маностати 11, 25, 29. Закрити крани 9 і 17.
4.2. Вимикачем випрямляча 28 включити електролізер 27. Спостерігаючи за рівнем електроліту в катодних і анодних просторах, поступово заповнити маностати 25 і 29. Цю операцію вважати завершеною після досягнення стаціонарного режиму роботи електролізера, що характеризується проходженням водню і кисню через маностати в атмосферу і збереженням постійними рівнів електроліту в катодному і анодному просторах.
4.3. Відкрити вентиль 2 на балоні з вуглекислим газом і за допомогою редуктора 3 встановити потрібну швидкість газу, спостерігаючи за його проходженням через маностат 4.
4.4. Газова суміш після крана 13 може спрямовуватися або в промивні склянки 12, або в маностат 11. Рівень води в маностаті повинен бути підібраний таким, щоб зміна краном 13 напрямку подачі газу не впливала на його швидкість (незмінність показань реометрів). З цієї самої причини об'єм розчину Ва(ОН)2 у склянках при проведенні аналізу газу і об'єми води в цих самих склянках при калібруванні реометрів в усіх дослідах повинні бути сталими.
4.5. Виконати операції з калібрування реометрів й аналізу вихідної газової суміші на вміст СO2 за вказаних викладачем швидкостей водню і вуглекислого газу відповідно до того, що було викладено вище.
4.6. Встановити крани 14 і 16 таким чином, щоб газова суміш проходила через реактор 17. Увімкнути нагрівання печі й домогтися встановлення в реакторі температури, заданої викладачем. Повторювати аналіз реакційної суміші на СO2 до досягнення сталості результатів. Після цього треба повторити аналіз вихідної газової суміші і знову проаналізувати рівноважну суміш. У разі незбігу результатів повторних аналізів з попередніми треба продовжити по черзі аналізи вихідної й рівноважної газових сумішей до одержання таких результатів, що відтворюються.
4.7. Воду, що збирається у відгалуженні 15, треба періодично зливати.
5. Послідовність здійснення операцій при вимиканні пристрою:
5.1. Вимкнути нагрівання печі і охолодити реактор, не припиняючи пропускання через нього газової суміші.
5.2. Злити воду з маностата 11.
5.3. Обережно, спостерігаючи за рівнем електроліту в електролізері та показаннями реометрів, знизити рівень води в маностатах 4, 25, і 29 до мінімально можливого.
5.4. Вимкнути електролізер. Закрити редуктор 3 і вентиль 2 на балоні з вуглекислим газом. Повністю відкрити крани 6, 26 і 30 та злити воду з маностатів.
Обробка одержаних результатів. Якщо позначити через V0, V1 та V2 об'єми розчину НС1, що витрачаються на нейтралізацію взятої кількості Ва(ОН)2, на нейтралізацію такої самої кількості Ва(ОН)2 після пропускання через неї вихідної газової суміші протягом τ хв і на нейтралізацію такої самої кількості Ва(ОН)2 після пропускання через неї рівноважної газової суміші протягом такого самого відрізка часу, тоді:
 ,
,
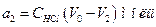 ,
,
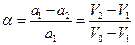 .
.
Після підстановки цього значення α у рівняння (2) з урахуванням співвідношення (4) отримаємо

За бажання внести поправку на вологість вихідного водню розрахунок можна вести за рівнянням
 .
.
Чисельні коефіцієнти в цьому рівнянні відповідають температурі 258 К, за якої тиск насиченої водяної пари дорівнюе 23,8 Тор, або 0,03 атм.
Звіт про роботу повинен включати термодинамічний розрахунокконстанти рівноваги і порівняння експериментальних і розрахованих значень КP.
Література: [23, с. 128-137; 25, с. 137-145].






