Мета роботи. Визначити теплоту окиснення щавлевої кислоти.
Методика роботи. Для визначення теплоти реакції окиснення (чи будь-якого іншого процесу) необхідно знати так звану сталу калориметра С. Ця величина являє собою суму теплоємностей усіх частин приладу, сумарну теплоємність системи. За фізичним змістом це кількість теплоти, необхідної для нагрівання на 1°С калориметра і усіх його частин, що беруть участь в теплообміні:  .
.
Для визначення С у даній роботі використовується електричний метод. Принцип його полягає в тому, що в зібраний калориметр через електронагрівач пропускають електричний струм протягом суворо визначеного часу (τ, с). Сила струму (І, А) та падіння напруги у нагрівачі (U, В) реєструються за допомогою приладів. Спостерігають викликану пропусканням електричного струму зміну температури. Кількість виділеної теплоти розраховують за законом Джоуля: 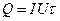 .
.
Якщо тепер у цьому калориметрі провести основний термохімічний процес, його тепловий ефект (Q) можна розрахувати за рівнянням:  , де Δt - дійсна зміна температури в цьому процесі.
, де Δt - дійсна зміна температури в цьому процесі.
Теплоту реакції окиснення визначають на прикладі реакції:


Порядок роботи. Підготувати прилад для проведення досліду (опис калориметра наведено у роботі № 4/1). Увімкнути термостат. Відміряти (піпеткою) в калориметричний стакан 50 мл води, 50 мл 30%-ного розчину Н2SО4 та 50 мл 1,25%-ного розчину КМnO4.
На технічних терезах зважити 0,2 - 1,0 г (g) щавелевої кислоти, перенести в зважену на аналітичних терезах ампулу і знову зважити на аналітичних терезах з точністю до 0,001 г.
Закріпити ампулу в кришці термостата.
Встановити в термостаті калориметричний стакан з розчинами Н2SО4 та КМnО4. Закріпити так, щоб ртутний резервуар термометра Бекмана був повністю вкритий водою.
Почати запис температури через кожні 30 с з точністю до 0,002°С. Зробити 10-11 відліків. Записавши час останнього відліку і не припиняючи запис температури, увімкнути електричний струм на 2-3 хв. Починаючи з моменту проходження струму відбувається нерівномірна зміна температури, яка триває деякий час після проходження струму і поступово переходить у рівномірну. Відліки температури нанести на графік температура - час. Зміну температури визначити графічним методом, як це описано в роботі № 4/1. Дослід з визначення сталої калориметра проводити тричі.
Охолодити калориметричний стакан до початкової температури, витримати 5-10 хв і почати запис температури, як у попередньому досліді. На 11-му відліку розбити пробійником ампулу (пробійник одразу вийняти), продовжуючи запис температури. Визначити графічно Δt.
Розрахувати молярну теплоту окиснення (Q) за рівнянням:  , де М - молекулярна маса щавлевої кислоти; g - наважка щавлевої кислоти.
, де М - молекулярна маса щавлевої кислоти; g - наважка щавлевої кислоти.
Література: [25, с. 142-143].






