Тепловий ефект хімічної реакції. Закон Гесса. Теплоти утвореннята горіння речовин. Стандартні ентальпії. Залежність теплових ефектів від температури, формула Кірхгофа.
Зміна енергій Гіббса та Гельмгольца протягом хімічного процесу. Рівняння ізотерми хімічної реакції Вант-Гоффа. Закон діючих мас. Константа рівноваги та способи її виразу (КР, Кс, Кx). Розрахунки складу рівноважних сумішей для хімічних реакцій. Константа рівноваги в неідеальних системах.
Залежність константи рівноваги від температури, рівняння ізобари та ізохори хімічної реакції. Інтегрування рівняння ізобари, розрахунки хімічної рівноваги за різних температур. Метод Тьомкіна - Шварцмана.
Зміщення рівноваги, принцип Ле-Шательє.
Гетерогенні хімічні рівноваги та особливості їх опису.
Література: [1-7, 9-11].
Робота № 4/1. Визначення теплоти гідратації СиSО4
Мета роботи. Вивчити методику і можливості калориметричних досліджень та експериментально визначити тепловий ефект гідратоутворення CuSO4·5Н2О (або іншого гідрату) з CuSO4 і Н2О за реакцією: 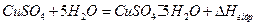
Порядок роботи.
1. Зібрати й підготувати до роботи калориметричну установку.
2. Визначити середню теплоємність калориметричної системи як описано нижче.
3. Експериментально визначити мольні теплоти розчинення безводного CuSO4 та його кристалогідрату у двох послідовних дослідах.
4. За різницею теплот розчинення CuSO4·5H2O і CuSO4 обчислити DHгідр сульфату міді в Дж/моль.
5. За законом Гесса знайти DHгідр за довідниковими даними, отриману величину порівняти з експериментальною.
6. Обчислити відносну і абсолютну похибки у визначенні DHгідр
7. Усі дані калориметричних спостережень та результати обчислень навести в протоколі і подати у вигляді таблиць та відповідних графічних залежностей.
На робочому столі зібрати калориметричну установку (рис. 1). Перевірка її готовності до роботи і попередній запуск на 10-15 хв здійснюються під наглядом викладача або інженера практикуму.
Термохімічне дослідження розпочинають з визначення теплоємності системи (сталої калориметру С), що являє собою кількість тепла, необхідного для нагрівання (або охолодження) на 1°С повністю готової до досліду калориметричної системи. До складу калориметричної системи входять усі частини калориметра, що беруть участь в теплообміні: внутрішній стакан (1), термометр Бекмана (2); ампула з наважкою солі (3), малопотужний нагрівач (4), мішалка (5), а також певна кількість води, що знаходиться в стакані. Теплоємність калориметричної системи визначають за співвідношенням:
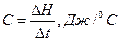 (1)
(1)
де DH визначають за формулою Джоуля – Ленца
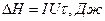 (2)
(2)
У формулах (1) та (2) Dt - зміна температури, °С; І – сила струму, що проходить через нагрівач (4), А; V - напруга, В; t - час проходження струму через нагрівач, с. Розрахунок сталої калориметра здійснюється за співвідношенням
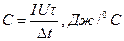 (3)
(3)
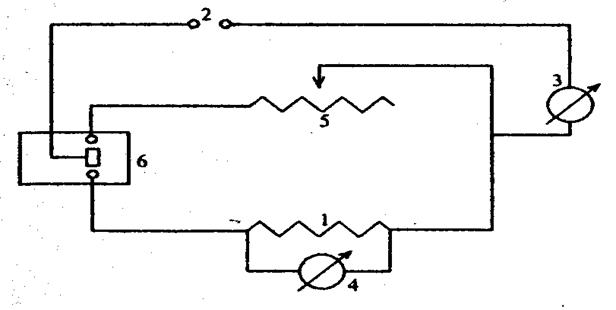
Електричну схема нагрівача для визначення теплоємності калориметричної системи наведено на рис.2. Опір нагрівача (І) підбирають таким, щоб швидкість нагрівання не перевищувала 0,5 - 1,0°С протягом 3-4 хв. Джерелом електроенергії може бути як акумуляторна батарея, так і випрямляч (2) напругою 4-6 В. Силу струму регулюють реостатом (5), а вимірюють амперметром (3), Для вимірювання напруги на затискачах нагрівача використовують вольтметр (4). Перемикачем (6) вмикають нагрівач і одночасно включають секундомір.
Виконання калориметричного досліду розпочинають з підготовки калориметра до роботи. У дюар (або стакан) заливають 400-500 мл води, температура якої близька або дорівнює кімнатній. Для того, щоб утворились розчини однакової концентрації, зважують дві порції по 10 г ретельно розтертого в порошок CuSO4·5H2O з точністю не вище 10-3.
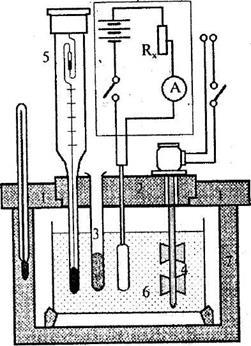
Рис. 1. Принципова схема калориметра: 1 - кришка зовнішня;2 -кришка внутрішня; 3 - ампула; 4 - мішалка; 5 - термометр Бекмана; 6 - посудина Дюара; 7 - зовнішня екзотермічна оболонка (штатив)
Першу з них всипають у висушену і заздалегідь зважену ампулу з корком і знову зважують для точного визначення маси солі. Після цього заправлену ампулу вмішують в окремий отвір кришки калориметра. Другу порцію солі нагрівають у тиглі на електроплитці, поки не видалиться вся кристалізаційна вода і сіль не стане білою.
|
| Рис. 2. Електрична схема нагрівача калориметра: 1 - нагрівач; 2 - акумуляторна батарея; 3 - амперметр; 4 - вольтметр; 5 - реостат (тренувальний опір); 6 - перемикач |
Слід мати на увазі, що вся кристалізаційна вода виділяється за температури 258°С. За t >258°С має місце частковий розклад сульфату міді на СuО і SО3. Ще неохолоджену сіль всипають в другу ампулу і також закривають корком. Якщо за першою пробою визначатиметься DHроз. CuSO4·5H2O, то за другою - DHроз. безводної солі за рівнянням
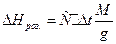 (4)
(4)
де М - молекулярна маса розчиненої солі; g - її наважка, г.
Теплоту гідратоутворення сульфату міді DHгідр відповідно до закону Гесса визначають як різницю між теплотою розчинення кристалогідрату сульфату міді та теплотою розчинення безводної солі
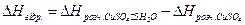 (5)
(5)
Через 10-15 хв, коли запрацювала мішалка і усталилась температура калориметричної системи, розпочинають відлік температури за термометром Бекмана з точністю не гірше 0,002 - 0,0030С (це п'ята або третя частина найменшої поділки, яку можна зафіксувати за допомогою лупи через 0,5-1 хв) (залежно від швидкості процесу) за допомогою секундоміра. Перед початком роботи термометр Бекмана[1] заздалегідь відрегульовують (під наглядом інженера) на вимірювання очікуваної зміни температури як при нагріванні (екзотермічний процес), так і при охолодженні (ендотермічний процес) шляхом переміщення деякої кількості ртуті між резервуарами термометра. З урахуванням кінетики теплообмінних процесів калориметра з навколишнім середовищем і для точного визначення зміни температури під час розчинення солі або іншої реакції дослід поділяється на три стадії (див. табл. 1,2);
а) попередня - розпочинається через 11 - 16 хв після вмикання мішалки і продовжується до того часу, поки не встановиться рівномірний хід зміни температури, тобто коли на кожні 0,5 - 1 хв 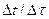 не стане однаковим. Як правило, цей період досліду не перевищує 10 хв;
не стане однаковим. Як правило, цей період досліду не перевищує 10 хв;
б) головна - розпочинається через 11 хв, коли вмикається нагрівач. У цей час за допомогою спеціального бойка (скляна паличка з гострим кінцем) швидко розбивають ампулу для перенесення солі у воду. Запис показників термометра продовжується 3 - 5 хв, тобто до 13 - 15-ої хвилини, коли остання точка лягає на пряму, що проходить через усі точки заключного періоду;
в) заключна - розпочинається після закінчення головного (16-та хвилина) і продовжується ще 10 хв (по 25-ту хвилину). Протягом цього часу завершується реакція гідратації солі, а процес розчинення солі або також закінчується, або переходить у стаціонарну стадію. За даними проведених вимірювань температура - час, що занесено до табл. 1, 2 для кожної з п'яти серій, будують графіки, необхідні для визначення стрибків температури Dt: три - для визначення середнього значення сталої калориметра і по одному - для розчинення безводного CuSO4 та CuSO4·5H2O.
Схему такої графічної побудови для екзотермічних процесів наведено на рис. 3.
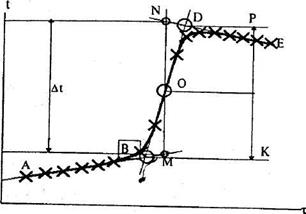
Рис. 3. Графічне визначення температури під час калориметричного досліду.
Після нанесення усіх дослідних точок однієї серії на міліметровий папір отримаємо криву АВDЕ. Відрізок АВ відповідає підготовчій стадії (10 хв), ВD - головній (5 хв) і DЕ -заключній (10 хв). Для графічного визначення величини стрибка температури необхідно знайти середину О кривої АВDЕ перетином прямолінійних відрізків АВ, ВD і DЕ. При цьому на їх перетині знайдемо дві точки –Р і К. Розділивши на дві рівні частини відстань між точками Р і К по ординаті, знаходимо середину кривої (точка О). Провівши через неї вертикаль МN до перетину з продовженням відрізків АВ і DЕ на ординату, отримаємо величину Dt, пропорційну значенню екзотермічного ефекту калориметричного досліду. Згідно з формулою (3), максимальне значення відносної похибки при визначенні сталої калориметричної системи визначається за рівнянням:
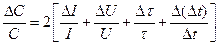 (6)
(6)
де DС - абсолютна похибка визначення теплоємності калориметричної системи; DI та DU - ціна найменшої поділки шкали ампер- і вольтметра, відповідно; Dt і Dt - найменші значення температури (°С) і часу (с), що фіксуються за термометром Бекмана і секундоміром. Похибку вимірювання інтегрального теплового процесу, що досліджується, знаходять за рівнянням:
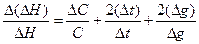 (7)
(7)
де g - наважка солі, що зважена на технічних терезах з точністю Dg.
Примітка. Зважування на технічних терезах наважки масою 10 г з точністю ±10-3 дає похибку 0,02%; якщо дослід продовжується до 5 хв, то можна отримати кінцевий результат з похибкою не гірше 1,0%.
Основним фактором, що впливає на величину похибки у визначенні DHгідр є точність вимірювання температури. Справді, якщо за допомогою термометра Бекмана обчислюють значення температури з точністю ±0,003°С, а при графічному визначенні Dt ця величина зростає майже вдвічі (наприклад, ±0,005°С), то за найбільш сприятливих умов, коли 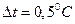 ,
,
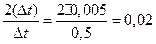 (або 2%)
(або 2%)
Із зменшенням наважки досліджуваної речовини величина ефекту – теж зменшується і, наприклад, 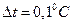 . Тепер величина похибки становить вже 10%. Отже, у першому випадку величина сумарної похибки в знаходженні результату становитиме 3%, а в другому - 11%, а з урахуванням точності визначення сталої калориметра максимальна похибка у визначенні теплового ефекту зросте ще на 5-10%.
. Тепер величина похибки становить вже 10%. Отже, у першому випадку величина сумарної похибки в знаходженні результату становитиме 3%, а в другому - 11%, а з урахуванням точності визначення сталої калориметра максимальна похибка у визначенні теплового ефекту зросте ще на 5-10%.
Протокол калориметричного досліду повинен містити такі відомості:
1. Мета, завдання, короткий зміст калориметричного дослідження. Основні рівняння.
2. Необхідні рисунки і схеми експериментальної установки.
3. Вихідні дані й кінцеві результати, що має бути зведено в таблиці за типом табл. 1 і 2.
4. Основні формули і схеми розрахункових операцій.
5. Графічні зображення і визначення.
6. Використані літературні дані.
7. Результати оцінки похибки вимірювань.
8. Висновки
Таблиця 1. Дані попередні й отримані в процесі визначення С
| Загальні дані | t, хв. | Хід зміни температур | t, хв. | Хід зміни температур | t, хв. | Хід зміни температур |
| Перша серія | ||||||
| Об’єм води, мл | ||||||
| Вага порожньої ампули з корком, г = | ||||||
| Те саме, але з наважкою, г = | ||||||
| Наважка кристалогідрату солі, г = | ||||||
| Друга серія | ||||||
| Вага другої ампули з корком, г = | ||||||
| Те саме, але з безводною сіллю, г = | ||||||
| Наважка безводної солі, г = | ||||||
| Напруга, В | ||||||
| Сила струму, А | Третя серія | |||||
| Час струму, хв. | ||||||
| С(1) =... С(2) =... С(3) =... | ||||||
| С | ||||||
Таблиця 2. Визначення зміни температури калориметра при розчиненні безводної солі та її кристалогідрату
| Стадія | ||||||
| Попередня (10 хв.) | Головна (3 – 5 хв.) | Заключна (10 хв.) | ||||
| t, хв. | хід зміни температур | t, хв. | хід зміни температур | t, хв. | хід зміни температур | |
| Безводна сіль. Маса, г = | ||||||
| Кристалогідрат солі. Маса, г = | ||||||
Література: [25, с. 139-140].






