Макромолекули можна уявити як довгі нитки, які скручені у клубок, або орієнтовані під дією сил напруги. Внаслідок рухомості ланцюгів макромолекул та теплового їх руху, вони безперервно переходять із однієї конфігурації в іншу, але найбільш вірогідною формою у вільному стані є скручена конфігурація. У всіх випадках має місце взаємодія між молекулами, і вся система являє собою єдине ціле. Деформація полімеру змінює його конфігурацію та викликає складне перегрупування ланцюгових молекул, зв’язану з подоланням сил взаємодії між ними. Якщо, наприклад, швидко розтягти зразок полімеру на динамометрі на 100% та виключити динамометр, то напруга, що виникла, з часом буде зменшуватись, як видно з графіка:
напруга
 |


час
Зменшення напруги свідчить про те, що макромолекули, виведені з рівноважних положень у момент деформації, переходять до нового рівноважного стану не відразу, а поступово. Перебудова макромолекул залежить від їх молекулярної маси, конфігурації і не може відбуватись відразу, а вимагає певного часу. Цей час тим більший, чим більша енергія міжмолекулярної взаємодії та чим менша енергія їх теплового руху. Встановлення рівноваги у системі, що вийшла з цього стану завдяки зовнішнім факторам, називають релаксацією. Залежність напруги від часу при постійній деформації називається – релаксацією напруги. Якщо до зразка полімеру підвісити тягар, який би створював постійну напругу, то відповідна йому деформація, яка настає поступово за досить великий проміжок часу, тобто зразок довго буде під впливом тягаря продовжувати розтягуватись. Добре це видно з наведеного графіка:
 деформація
деформація
 | ||
 |
час
Час розвитку деформації, як і час падіння напруги, у значній мірі залежить від температури. Чим вона вища, тим швидше буде проходити перебудова макромолекули і тим швидше розвиватиметься деформація при постійному навантаженні. Якщо у деякий момент припинити дію розтягуючої сили, то ланцюгові молекули почнуть перебудовуватись у зворотному напрямку, тобто розтягнутий зразок буде скорочуватись. Це явище носить назву – пружного наслідку. Якщо зразок ВМС спочатку деформувати, рівномірно розтягуючи його, то, після усунення деформуючої сили відбудеться скорочення зразка. Але деформації, що виникали спочатку, під час росту, і потім, під час зменшення напруги будуть зовсім різними. Внаслідок цього графік “напруга - деформація” буде мати вигляд петлі. При повторенні циклу з тим же зразком одержують нову петлю, яка не співпадає з першою. Явище отримало назву – гистерезису, яке може бути проілюстровано графічно:
напруга

деформація
Форма петлі залежить від умов експерименту (швидкості зміни та величини коливань напруги або деформації, температури та ін.), природи полімеру. Гистерезис у перекладі з грецької означає “відстаю, запізнююсь”, що в цілому характеризує залишкові властивості тіла, які можна спостерігати після припинення зовнішньої дії. Можна спостерігати різні випадки гістерезисну, наприклад: гістерезис в’язкості, гістерезис оводнення, обезводнення, сорбційний гістерезис. Релаксаційні процеси у полімерах мають важливе значення і повинні враховуватись при виготовленні виробів з ВМ матеріалів (штучні та синтетичні волокна, плівки, гумові вироби, пластмаси, лакові покриття, штучна та натуральна шкіра, органічне скло), як і при їх експлуатації.
Розчини полімерів
Перш, ніж розглянути явище розчинення полімеру, треба ознайомитись з тим, які явища відбуваються при додаванні невеликих кількостей розчинника до сухого зразка полімеру. Якщо у макромолекулу полімеру входять полярні групи, то ланцюг буде жорсткий. Його можна зробити гнучким, а продукт еластичним, якщо зменшити силу міжмолекулярної взаємодії. Така зміна гнучкості полімерного ланцюга лежить у основі важливого виробничого процесу – пластифікації. Пластифікація може бути як зовнішня, так і внутрішня.
Зовнішня пластифікація полягає у додаванні до чистого полімеру невеликих кількостей розчинника, який хімічним складом близький даному полімеру. Полімер поглинає низькомолекулярну рідину, молекули якої притягуються полярними групами до полярних груп полімеру, послабляючи при цьому дію сил міжмолекулярного кріплення та збільшують гнучкість ланцюгів. Одна молекула рідини здатна блокувати одну полярну групу у молекулі полімеру.
Внутрішня пластифікація – співполімеризація, тобто полімеризація суміші мономерів, причому один з них повинен давати еластичний полімер. У ланцюзі одержаного співполімеру чергуються ланки ланцюгів обох мономерів, що й обумовлює його еластичність. Пластифікація знижує температуру склування полімеру і підвищує його еластичність. Це надає виробам цінних експлуатаційних властивостей. Відбираючи пластифікатор, слід мати на увазі, що гарним пластифікатором для полімеру буде та низькомолекулярна рідина, у якій цей полімер набухає. Процес набухання полягає у тому, що висомолекулярний полімер, поглинаючи значну кількість низькомолекулярної рідини (розчинника), збільшується у об’ємі та вазі. Набухання – це однобічне змішування рідин. Воно може бути граничним і безграничним. Граничне набухання не закінчується розчиненням. Наприклад, так набухає вулканізований каучук у вуглеводах. Безграничне набухання закінчується розчиненням (натуральний та синтетичний каучуки у вуглеводнях). Математично ступінь набухання (α) характеризується формулою:
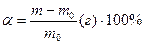 ;
;
де m – маса полімеру після набухання (г);
mо – маса полімеру до набухання (г).
Якщо обмежити об’єм набухаючого полімеру, але зберегти доступ до нового розчинення, то виникає великий тиск на стінки посудини, що містить полімер. Він може досягти 5-10 ат і називається тиском набухання. По своїй природі він схожий на осмотичний тиск. Набухання полімерів йде з певною швидкістю. Вимірюючи через певні проміжки часу ступінь набухання, можна дослідити кінетику цього процесу. Набухання полімерів є вибірковим явищем. Вони здатні набухати далеко не в усіх рідинах, а лише у тих, які близькі їм по хімічній будові. Так, вуглеводневі полімери набухають і розчиняються у різних вуглеводнях (бензині, бензолі), тоді як полімери, що мають полярні групи, набухають у полярних розчинниках (у воді, ацетоні, спирті).
Набухання полімерів супроводжується вилученням тепла. Так, при набуханні 1г сухого желатину виділяється 5,7 кал, 1г крохмалю – 6,6 кал. Тепловий ефект носить назву теплоти набухання. Слід розрізняти інтегральну теплоту, яка виділяється при набуханні 1г сухого полімеру до його повного насичення або до якоїсь певної концентрації.
Дифузійну теплоту розраховують з інтегральних теплот. Це така теплота, яка виділяється при поглинанні 1г рідини сухим або набухлим полімером. Набухання має велике значення у природі та життєдіяльності людини. Так, при проростанні зерна, у шкіряно - галантерейному виробництві, при виготовленні взуття, одягу, у виробництві клею спостерігаємо процеси набухання. Кулінарна обробка продуктів: борошна, круп, овочів, м’яса тісно пов’язана з процесом набухання.
В’язкість
Характерна властивість розчинів ВМС є їх висока в’язкість. В’язкість, у загальному понятті цього слова називають іноді внутрішнім тертям, що являє собою опір рідини її рухові під дією зовнішніх сил. Внутрішнє тертя у рідинах обумовлене силами скріплення між молекулами. Яскравіше всього внутрішнє тертя проявляється у рідині, що тече під дією зовнішньої сили по трубі (або капіляру у лабораторних умовах). Сила “F”, що виникає при цьому, дорівнює по величині і обернена по напряму зовнішній силі:
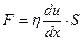 ,
,
де η – коефіцієнт в’язкості або в’язкість, величина постійна (дн·сек./см2);
du/dx – градієнт швидкості;
S – площа контактів рухомих площин рідини (формула Ньютона).
Одиниця в’язкості у системі СГС – пуаз (на честь французького вченого Пуазейля). 1 пуаз відповідає в’язкості рідини, при якій сила у 1 дину діє на площу в 1см2 у напрямку руху рідини, викликає течію з градієнтом швидкості, що дорівнює одиниці. Так, в’язкість води при 20 оС дорівнює 0,01 пуаза. Формула Ньютона може бути застосована для чистих рідин, розведених розчинів ВМС та деяких колоїдів. Розчини ВМС та колоїди з анізодіаметричними часточками не відповідають закону та формулі Ньютона. Для таких розчинів характерна аномальна в’язкість. Відомі дві аномальні в’язкості. Перша аномалія полягає у зменшенні в’язкості, коли рідина тече по трубі або капіляру під дією зовнішніх сил. Пов’язана вона із зміною конфігурації макромолекули або колоїдних часточок. Довгі макромолекули або часточки можуть спричиняти різний опір потоку у залежності від того, як вони розташовані (якщо поперек – ефект опору найбільший, вздовж – опір найменший). Із збільшенням тиску швидкість течії розчинів швидко збільшується, бо довгі макромолекули та частки орієнтуються вздовж стінок, в’язкість різко зменшується. Друга аномалія полягає у тому, що непропорційно росту концентрації сильно збільшується в’язкість. Пов’язана вона з утворенням під дією молекулярних сил особливих структур у вигляді сіток, у петлях яких знаходиться механічно захоплений розчинник. Такі структури сильно загущують названі системи. Тому завдяки цим аномаліям в’язкість у розчинах ВМС завжди вища, ніж розрахована за формулою Ейнштейна: ŋ = ŋо(1+0,25φ),
де, ŋо – в’язкість розчинника;
η – в’язкість розчину;
φ – об’ємна концентрація.
В’язкість сильно залежить від молекулярної ваги полімеру, його форми, взаємодії між окремими ланцюгами у полімері.
В ’язкість розчину завжди більша в’язкості чистого розчинника.
Відношення ŋ/ŋо – відносна в’язкість.
(ŋ - ŋо)/ŋо – питома в’язкість.
Між ними є певна залежність: ŋпитома = ŋвідп - 1
Залежність ŋ пит. від концентрації (С, г/100мл) та молекулярної ваги (М) характеризується рівнянням Штаудингера: ŋпитома/С = КМ, де К – постійна величина.
ŋ приведена в’язкість = ŋ питома/С
Граничне значення приведеної в’язкості у безкінечно розбавлених розчинах називається характеристичною в’язкістю [η].
Залежить [η] від молекулярної ваги, характеризується рівнянням:
[ŋ] = [ŋпит/С] = КМа;
C→0;
[ŋ] = КМа;
де “К” та “а” - постійні величини. Величина “а” характеризує ступінь скручування, еластичність. Тверді полімери мають а = 1, а в еластичних полімерах а = 0,5.
Із збільшенням температури в’язкість зменшується, тому що збільшується тепловий рух молекул, що заважає утворенню просторових структур. Іноді підвищення температури викликає незворотні процеси – деструкцію. Характерно впливають різні добавки. Наприклад, солі кальцію сильно підвищують в’язкість розчинів нітроцелюлози, ацетилцелюлози, желатину. Подібно розчинам низькомолекулярних речовин, розчини ВМС можна розділити на електроліти та неелектроліти. У перших - молекули дисоціюють на іони, а в других – ні. Важливі ВМ електроліти – це водні розчини білків. Білки та їх розчини лежать у основі життєдіяльності живих організмів і містяться у великій групі харчових продуктів.
Якщо помістити водний розчин білка в електричне поле, то макромолекули білка почнуть рухатись або до катоду, або до аноду – у залежності від рН середовища.
Молекули білка містять, як відомо, основні групи – NH2 та кислотні – СООН. Такі сполуки є амфотерними, тобто вони здатні дисоціювати по кислотному та основному типу. Як кислота білок дисоціює:
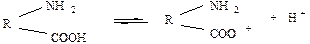 ;
;
Як основа:
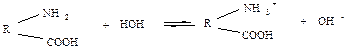 .
.
Але при певному значенні рН ступінь дисоціації аміногруп та ступінь дисоціації карбоксильних груп набувають однакового значення. Іноді макромолекули білка стають електронейтральними, тобто посилають у розчини рівні кількості іонів Н+ та ОН – . Для них як для колоїдів настає ізоелектричний стан, у якому різко змінюються властивості білкових розчинів. Значення рН, що відповідає ізоелектричному стану, називається – ізоелектричною точкою (ІЕТ). Для більшості білків вона відповідає кислим розчинам (рН <7). Для казеїна – 4.6; желатина – 4.7; глобулину – 5.4.
Дослідне визначення ІЕТ білкових розчинів, як і визначення ізоелектричного стану колоїдів, може бути проведено різними методами – прямими і непрямими. Прямі методи полягають у спостереженні за поведінкою часток у електричному полі при електрофорезі – або макроскопічно у особливих електрофоретичних апаратах, або мікроскопічно у кюветі ультрамікроскопа. Відсутність межі поділу фаз, зміщену до того чи іншого електроду у електрофоретичному апараті, або окремих часток у полі ультрамікроскопа служить показником ізоелектричного стану даного колоїду чи розчину ВМС. Потім залишається визначити тим чи іншим методом рН цього розчину. Непрямі методи полягають у спостереженні максимума або мінімума тої чи іншої фізичної властивості, що змінюється із зміною дзета потенціалу. Найбільше розповсюдження одержали:
1. Визначення по ступеню коагуляції. У пробірки наливають буферні розчини з різним значенням рН, додають рівні кількості досліджуваного розчину білка і додають для гідратації спирт. Найбільше помутніння буде у пробірці, рН якої відповідає ІЕТ.
2. Визначення по величині набухання. Невеликі наважки сухого білка насипають у ряд пробірок, приливають рівні об’єми буферних розчинів із різним значенням рН. Найбільше набухання спостерігаємо у пробірці, що відповідає ІЕТ.
3. По швидкості желатинування. Швидше всього желатинування відбувається у пробірці з ІЕТ.
Невелике додавання нейтральних електролітів до водних розчинів ВМС іноді викликає помутніння розчинів, зміну в’язкості та осмотичного тиску.
Виникають явища, дуже схожі зі скритою коагуляцією типових колоїдів, їх явища часто викликає хімічна взаємодія.
Якщо до водних розчинів ВМС додають висококонцентровані (насичені) розчинники нейтральних солей, то ВМ речовина випадає із розчину в осад. Цей процес висолювання аналогічний явній коагуляції. Різниця полягає у тому, що для коагуляції колоїдів необхідно додати мінімальну кількість електролітів, а для висолювання ВМС – великі кількості. Процес висолювання полягає у тому, що іони нейтральних солей, гідратуючись, віднімають воду у молекул полімерів. Очевидно, що вирішальну роль відіграє гідратуюча здатність солей. Висолююча здатність характеризується аніонами, які по силі їх висолюючої дії можна розташувати у слідуючий ліотропний ряд:
C2O42->SO42->CH3COO - >Cl - >NO3 - >Br ->I - >CN5
У аналогічний ряд, але з меншою висолюючою дією можна розташувати катіони:
Li+ > Na+ > K+ > Rb+ > Cs+;
Mg2+ > Ca2+ > Sr2+ > Ba2+.
На висолювання великий вплив має ступінь розчинності самого полімеру у даному розчиннику: чим вона нижча, тим швидше і повніше відбувається висолювання. Найбільш сильно процес висолювання відбувається у ІЕТ (Е=0). Велике значення має цей процес у технологічних процесах: миловарінні при одержанні твердих мил, при висолюванні барвників, каніфолі, у виробництві штучного волокна, фракціюванні ефірів целюлози і т.п.
Якщо у розчинних ВМС змінити температуру або ввести у них низькомолекулярні речовини, то спостерігається коацервація. Процес полягає у розділенні полімеру на два шари:
- розчин ВМС у розчиннику;
- розчинник у розчині ВМС.
Розчин більш багатий ВМ речовиною, відокремлюється у вигляді маленьких крапельок, які потім можуть утворювати суцільний шар. Одна з умов цього процесу є значення дзета потенціалу, близького до нуля.
Фізико-хімічні властивості коацерватів нагадують властивості протоплазми (згідно теорії Опаріна, коацервація мала велике значення в історії виникнення життя на Землі).
ЧАСТИНА VI
ГЛОСАРІЙ
Абсорбція – це поглинання, що розпочинається на поверхні та поширюється на глибину адсорбенту.
Адсорбція – це зміна концентрації речовини на поверхні у порівнянні з концентрацією у середині фази.
Адсорбент – це речовина, яка поглинає своєю поверхнею.
Аніоніти – це іоніти, що мають позитивний заряд та адсорбують з розчину аніони.
Активні молекули – це молекули, що володіють енергією активації.
Гідрофільна поверхня – це тверді поверхні, що добре змочуються водою.
Гідрофобна поверхня – це поверхня, на яких вода не розтікається і утворює з поверхнею тупий крайовий кут.
Граничний кут – це такий кут падіння, кут заломлення якого дорівнює 900.
Десорбція – це процес обернений адсорбції.
Дисперсні системи - це системи, в яких одна речовина у вигляді частинок різної величини розподілена в іншій речовини.
Ебуліоскопічна та кріоскопічна константи показують на скільки градусів розчин, який містить 1 моль речовини в 1000 г розчинника, вище закипає чи нижче замерзає, ніж чистий розчинник.
Еквівалентна електропровідність – це величина електропровідності розчину, який містить 1 г-екв електроліту, розташованого між електродами, що знаходяться на відстані 1 см один від одного.
Електропровідність – це властивість речовини проводити електричний струм.
Енергія активації – це надлишкова енергія в порівнянні з середньою енергією, якою повинна володіти молекули, щоб їх зіткнення призвело до хімічної реакції.
Закон дії мас - швидкість хімічної реакції прямопропорційна добутку концентрацій реагуючих речовин, взятих у ступені, яка дорівнює стехіометричному коефіцієнтові, що стоїть перед формулою даної речовини в рівнянні реакції.
Закон Вант-Гоффа - осмотичний тиск розбавленого розчину на напівпроникну мембрану дорівнює тому газовому тискові, який би спричиняла розчинена речовина, якщо б вона у вигляді газу при такій же температурі займала той же об’єм, що й розчин.
Закон Рауля – відносне зниження тиску пари розчинника над розчином дорівнює мольній долі розчиненої речовини.
Ідеальні розчини – це суміші розчинів, в процесі утворення яких відсутні теплові та об’ємні ефекти.
Іоніти. - це адсорбенти, які мають властивість поглинати обмінним шляхом іони з розчину.
Колориметрія – це фізико-хімічний оптичний метод аналізу, за допомогою якого визначають концентрацію досліджуваного забарвленого розчину.
Концентрація – це кількість речовини, яка міститься у визначеній кількості розчину.
Кондуктометрія – це вимірювання електропровідності розчинів.
Концентрація – це кількість речовини, яка міститься у визначеній кількості розчину.
Лівообертаючі оптично активні речовини – це такі речовини, які обертають площину поляризації на певний кут вліво (проти годинникової стрілки) і величина обертання негативна.
Мікрогетерогенні системи – це дисперсні системи, часточки дисперсної фази у яких дорівнюють»10-3-10-5см (від 0,1-10мк).
Молекулярність реакції визначається числом молекул, одночасною взаємодією між якими відбувається елементарна хімічна реакція.
Нефелометричний метод аналізу -заснований на вимірюванні інтенсивності розсіяного світлового потоку, який проходить крізь дисперсну систему.
Осмосом – це односторонній перехід (дифузія) розчинника крізь напівпроникну мембрану з розчину з меншою концентрацією у розчин з більшою концентрацією (чи розчинника до розчину).
Осмотичний тиск – це сила, яка зумовлює осмос й відношення до одиниці поверхні напівпроникної мембрани.
Осмометри – це прилади, які вимірюють осмотичний тиск.
Площина коливання – це площина в якій відбувається коливання променя
Площина поляризації – це площина перпендикулярна до площини коливання.
Поверхневий натяг – це робота, яка витрачена на утворення 1 см2 поверхні розділу фаз, або еквівалента їй вільна енергія, що приходиться на 1 см2 поверхні.
Поляриметр – це прилад на вимірюють кут обертання площини поляризації оптично активних речовин.
Поляризація - надбання молекулою полярності.
Поляризоване світло – це такі поперечні коливання, які однонаправлені та відбиваються в одній площині. Площина в якій відбувається коливання променя називається площиною коливання, а площина перпендикулярна до неї називається площиною поляризації.
Поляризуємість – властивість молекул, атомів та іонів у електричному полі (Е) набувати дипольний момент
Показник заломлення (n) - це відношення синуса кута падіння променя світла до синуса кута його заломлення.
Потенціометричний аналіз -метод визначення концентрації (активності) іонів, заснований на вимірі рівноважного потенціалу електрода, зануреного у випробуваний розчин.
Порядок реакції – визначають по більш формальній ознаці, ніж її молекулярність: по вигляду рівняння, що визначає залежність швидкості реакції (υ) від концентрації (С) реагуючих речовин.
Правило Вант – Гоффа - при підвищенні температури на кожні 100 С швидкість хімічної реакції збільшується у 2-4 рази.
Правило Траубе - збільшення довжини вуглеводневого радикалу в ефірних кислотах на групу – СН2 збільшує їх здатність до адсорбції в 3,2 рази, а поверхневий натяг в цю кількість разів зменшується.
Правообертаючі оптично активні речовини це такі речовини які обертають площину поляризації на певний кут в право (за годинниковою стрілкою) і вважається величина обертання позитивною.
Реальні розчини можуть бути лише більш чи менш близькі до ідеальних розчинів.
Рефрактометрієя - метод аналізу, який базується на визначенні показника заломлення досліджуваного розчину.
Рефракція - зміна напрямку прямолінійного розповсюдження світла при переході з одного середовища в інше середовище.
Розчини – це двох - чи багатокомпонентні гомогенні системи, склад яких може змінюватися у широких межах.
Розчинник - речовина, яка при розчиненні не змінює свого агрегатного стану.
Турбідиметричний метод аналізу – заснований на вимірюванні послаблення світлового потоку, який проходить крізь дисперсну систему.
Хімічна кінетика – це розділ фізичної хімії, який вивчає швидкість та механізм хімічної реакції, залежність швидкості від різних факторів.
Хемосорбція - це поглинання, яке супроводжується хімічною взаємодією.
Швидкість хімічної реакції - це зміна концентрації реагуючих речовин за одиницю часу.
Список рекомендованої літератури
І. Основна література:
1. Болдырев А.И. Физическая и коллоидная химия. –М.: Высшая. школа, І983. – 504с.
2. Ляликов Ю.С. Физико-химические методы анализа. – М.: "Химия", І974. – 536с.
3. Васильев В.П. Аналитическая химия. Т II. – М.: Высшая школа, 1989. – 384с.
ІІ. Додаткова література:
4. Хмельницкий Р.А. Физическая и коллоидная химия. – М.: Высшая школа, 1988. – 400с.
5. Скоробогатий Я.П. Фізико-хімічні методи аналізу. – Львів, 1998. – 164с.
6. Кудрик М.А., Плахотіна Ж.Є., Стебліна К.П. Лабораторний практикум для студентів ІІ курсу спец. №7.0503.01 і №7.0503.02". – Полтава. 1996.
Зміст
| Вступ | |
| Тематичний план курсу | |
| Програма курсу | |
| Частина І. Лабораторний практикум | |
| Частина ІІ.Завдання та методичні рекомендації для самостійної роботи студентів | |
| Частина ІІІ.Тести контролю знань студентів | |
| Частина ІV.Завдання контрольних робіт та методичні рекомендації до їх виконання для студентів заочної форми навчання | |
| Частина V. Опорний конспект лекцій | |
| Частина VІ.Глосарій | |
| Список рекомендованої літератури |






