Міцела міцела
Рис. 5. Будова міцел мила.
Міцели мил мають різко виражену дифільність (складаються з полярної частини - СООК; СООNa та неполярної – вуглеводневий радикал). Молекули мила частково дисоційовані так, що навколо ядра утворюється подвійний електричний шар іонів, який добре гідратується. Цим пояснюється гарна розчинність мила у воді.
У розведених розчинах мил утворюються переважно кулеподібні міцели. З підвищенням концентрації їх кількість зростає. Потім вони починають перебудовуватись у пластинчасті міцели. Вони мають властивості обернено перебудовуватись. Розведення розчину викликає розпад міцел на молекули мила, тоді як розведення агрегативно стійкого колоїда зменьшує кількість міцел. Розчини мила ліофільні, термодинамічно стійкі, обернені системи.
Для них характерна слідуюча особливість: вуглеводні у воді не розчиняються, але коли у воді є невелика кількість розчину мила, то такі вуглеводні, як бензол, гексан, розчиняються у воді. Мильний розчин вуглеводня прозорий, так як вуглеводень поглинається внутрішньою частиною міцели мила, розташовується між його вуглеводневими ланцюгами. Це збільшує розмір міцели (рис.6).

Вода
Бензол
Вода
Рис.4. Схема солюбілізації бензолу у пластинчатій міцелі миючого засобу, розчиненого у воді.
Таке явище колоїдної розчинності одержало назву солюбілізації. Завдяки цьому явищу можна полізувати дієнові вуглеводні у водних розчинах та одержувати синтетичні латекси, водні розчини полімерів, які мають важливе значення у виробництві промислових товарів (гумові вироби, штучна шкіра, плащові матеріали). Найбільш важливою властивістю мила, миючих засобів є їх миюча дія. Цей процес включає: змочування, пептизацію (розчинення), емульгування, стабілізацію забруднення.
При емульгуванні утворюється стійка емульсія з маслоподібних, сажових і інших забруднень, які припиняють їх прилипання до поверхні тканини, що відмивають.
Тертя, перемішування, кип’ятіння сприяють взаємодії миючих засобів з забрудненою поверхнею, викликають густе, стійке піноутворення, припиняють осідання забруднень на тканину. Миюча дія збільшується при t = 60о. Більш висока температура зменшує її, тому що погіршується міцелоутворення, знижується структурно-механічні властивості адсорбційних шарів. Механізм миючої дії характерний для різних миючих засобів.
Зараз досягнуті успіхи у збільшенні виробництва синтетичних миючих засобів, що замінюють при пранні мило, одержане з натуральних жирів. Ці засоби збільшують строк використання вовняних, шовкових, бавовняних, льняних тканин. Миюча здатність цих засобів у 2-3 рази вища, ніж господарського мила, з успіхом вони використовуються у воді з підвищеним вмістом солей кольцію, магнію.
ТЕМА: Гелі та драглі
Класифікація драглів
Більшість розчинів ВМС (агар-агар, желатин), колоїдних розчинів (Fe(OH)3, H2SiO3) при певних умовах можуть переходити у особливий твердий стан без розподілу фаз. Процес носить назву застуднівання або желатинізація, а продукт – студень або гель.
Студнями та гелями називають такі дисперсні системи, у яких частинки дисперсної фази не рухаються вільно, як у розчинів, а зв’язані між собою. Дисперсійне середовище займає проміжки між зв’язаними міцелами. Драглі, або гелі – це колоїдні розчини, які повністю або частково втратили агрегативну стійкість, але зберегли кінетичну (за рахунок броуновського руху). До гелів можна віднести каучук, клей, желатин, текстильні волокна тканини рослинного та тваринного походження, більшість продуктів харчової промисловості (тісто, хліб), мармелад, мінерали (агат,опал). Бідні на рідину або зовсім сухі драглеподібні речовини називають ксерогелями.
Існують драглі, що містять мало сухої речовини (1-2 %). Наприклад: кисіль, холодець (м’ясний). Такі багаті на рідину драглеподібні системи одержали назву ліогелей. Особливу групу гелів утворюють драглисті осади, які одержують при коагуляції колоїдів (Fe(OH)3, H2SiO3), пластівці ВМС при висолюванні розчинів. Такі осади, які включають дисперсійне середовище, неоднорідні (кінетична стійкість порушена), називають коагелями. Не слід плутати з гелями пасти, які є суспензіями, що втратили текучість завдяки високій концентрації.
Розчини ВМС у порівнянні з колоїдними утворюють драглі (з-за високої в’язкості, яка росте з ростом концентрації швидше, ніж у колоїдах). Драглі можуть бути еластичні і нееластичні (крихкі). Приклад еластичного драглю - желатин, каучук у бензолі. Нееластичний (крихкий) студень – це кремнійова кислота. Накінець, всі драглі можуть бути обернені та необернені. Оберненими є: желатин, тваринний клей; необерненими: гідроксиди металів, важкорозчинні солі.
Методи одержання студнів.
1. У результаті хімічних реакцій:
Na2SiO3 + 2HCl ® H2SiO3 + 2NaCl,
студень.
2. У результаті полімеризації, хімічної поліконденсації (синтетичний каучук, пластмаси).
3. З кристалів неорганічних солей (хлоридів металів) при взаємодії їх з безводним рідким аміаком.
4. У результаті бактеріологічного і ферментативного процесу (кисляк, кефір).
Різні способи одержання студнів можуть бути розділені на дві групи:
- желатинування розчинів;
- набухання сухих речовин (ксерогелів) у відповідному середовищі.
Процес желатинування – це своєрідна коагуляція, коли з дисперсною фазою випадає в осад дисперсійне середовище. При желатинуванні зростає в’язкість. На цей процес впливають: концентрація, температура, час, електроліти, форма частинок. Електроліти діють по-різному у залежності від концентрації і хімічної природи. Сульфати (SO42-) сприяють застуднюванню, роданіди (CNS-) значно затримують цей процес. Аніони різняться по впливу на цей процес, як видно з ліотропного ряду аніонів:
SO 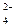 >Cl
>Cl 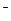 >NO
>NO 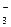 >I
>I 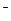 >CNS
>CNS 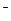 .
.
Катіони дуже мало відрізняються один від одного. При застудніванні білків велике значення має рН середовища. Процес цей значно зростає при наближенні рН до ІЕТ. Добре желатинуються частинки у вигляді стрічок, ниток, листочків. Наприклад, стрічкоподібні часточки V2O5 утворюють студні, навіть з 0,05% V2O5.
Процес желатинування відіграє велику роль у харчовій промисловості, у кондитерській справі, технології штучного волокна, вибухових речовин.
Властивості драглів
Для студнів характерні ряд властивостей твердих тіл: вони зберігають форму, мають пружність, еластичність. Механічні властивості визначаються концентрацією і температурою. У залежності від концентрації вони можуть бути дуже малої пружності або, навпаки, малоеластичними, твердими. Цю властивість слід враховувати при одержанні харчових драглів. Тому що, і інше значно погіршує якість продукту.
При нагріванні драглів переходять у в’язкотекучий стан. Цей процес називають плавленням. Процес обернений, бо при охолодженні розчин знову застудніває.
Багато студнів здатні переходити у рідкий стан при механічному впливові на них (перемішуванні, струшуванні). Цей процес обернений, так як у стані спокою через деякий час розчин знову застудніває. Властивість драглю багатократно ізотермічно розріджуватись при механічному впливові та застуднівати у стані спокою носить назву тиксотропії. К тиксотропним змінам здатні, наприклад, шоколадна маса, маргарин, тісто.
Через те що до складу студня входить велика кількість води, він має властивості рідини. У них можуть відбуватись різні фізико-хімічні процеси: дифузія, хімічні реакції між речовинами.
Дифузія у драглях низькомолекулярних речовин не відрізняється від дифузії у чистих розчинах.
Швидкість дифузії залежить від концентрації студня та щільності структурної сітки. Зі збільшенням концентрації речовини студня швидкість дифузії знижується, що пов’язано зі зменшенням розмірів петель сітки драглю.
Здатність до дифузії у драглях залежить від ступені дисперсності частинок дифундуючих речовин. Барвники – мають велику ступінь дисперсності і тому дифундують краще, ніж грубодисперсні частинки.
Дифузія відіграє дуже велику роль у технологічних процесах: дифузія солі і цукру у тісті, барвників і смакових речовин у желе, мармеладі та ін.
Для драглів, що містять електроліти, властива електропровідність, яка приблизно дорівнює електропровідності розчинів, з яких вони одержані. Розчинник, що міститься у студні, являє собою середовище, в якому можуть рухатись іони. Драглі з добре дифундуючими іонами мають високу електропровідність. На цій властивості засновано використання драглів у гальванічних ланцюгах, наприклад, у батарейках фонарів.
Синерезис драглів
Свіжовиготовлені драглі з часом змінюються, тому що прцес структуроутворення продовжується. При цьому на поверхні драгля з’являються крапельки рідини, які, зливаючись, утворюють рідку фазу. Рідка фаза є нечистим розчинником, а розведеним розчином полімеру. Дисперсна фаза замикається драглеподібною. Такий процес розділення драглю на дві фази, що супроводжується зміною об’єму драгля, називається синерезисом (відмонням). Драглі, стискаючись у процесі синерезису, зберігають форму посуду, куди були налиті у вигляді рідини до застуднювання.
Швидкість синерезису залежить від температури, концентрації. Підвищення температури сприяє синерезису. При значному підвищенні температури драгель переходить у розчин. З підвищенням концентрації швидкість синерезису зростає. Збільшення частинок дисперсної фази веде до зменшення відстані між ними і збільшення числа зв’язків між ними. Це приводить до ущільнення структурної сітки та її стягування.
У білкових драглів швидкість синерезису залежить від величини рН. Для студнів амфотерних білків швидкість синерезису максимальна у ІЕТ.
Синерезис у студнів, що утворені поліматеріалами, обернений, якщо при зберіганні не виникають які-небудь хімічні процеси. Іноді достатньо нагрівання, щоб студень з процесом синерезису поернувся у свій початковий стан. У кулінарній практиці цим засобом користуються, наприклад, для оводнення каш, пюре, черствого хліба. Практичне значення синерезису може бути як бажаним, так і небажаним. Частіше всього синерезис у побуті і промисловості небажаний. Це черствіння хліба, відмокання мармеладу, желе, карамелі, фруктових джемів. Синерезис відбувається і при зберіганні мила, клея і т.п. Прикладом позитивного синерезису може бути відділення рідини при виробництві сиру.
Зв’язана вода в драглях, гелях, її особливості
У набухлому полімері розрізняють два види води: зв’язану, або гідратаційну, та вільну, або капілярну.
Зв’язана вода залежить від гідрофільності полімеру. Вміст зв’язаної води у желатині у два рази перевищує масу сухої речовини. Зв’язана вода відіграє роль середовища. Молекули вільної води рухаються хаотично, молекули зв’язаної води менш рухомі. Завдяки цьому вона надає білковим драглям здатність зберігати свою форму. Наприклад, у медузи 1 % сухої речовин, а 99 % води.
Якщо при зберіганні студня виникають хімічні процеси, то синерезис, як відомо, ускладнюється і його оберненість втрачається, відбувається старіння драглю. При цьому драгель втрачає здатність утримувати зв’язану воду. Так, наприклад, у свіжому хлібі кількість зв’язаної води досягає 83%. Після зберігання хліба строком п’яти діб зв’язаної води залишається вже 67%. Відбулось черствіння хліба, тобто втрата здатності зберігати зв’язану воду. Такий синерезис розвивається навіть у живих організмах. Відомо, що м’ясо молодих тварин сочніше, м’якше, ніж старих. Це пояснюється тим, що з віком тканини тварин із-за синерезису, дегідратації стають більш жорсткими, твердими.
Зв’язана вода нижче 0о С не замерзає, від співвідношення вільної і зв’язаної води залежить морозостійкість рослин. Чим більше зв’язаної води, тим вони більш морозостійкі.
У ґрунті теж існує два види води. При засусі зв’язана вода переходить у звичайну, яка використовується рослинами.
ТЕМА: Високомолекулярні сполуки
Загальна характеристика і класифікація ВМС
ВМС мають велике значення у різноманітних галузях промисловості і сільського господарства. Велика їх роль у життєдіяльності тварин, рослин, людини.
Натуральний шовк, бавовна, луб’яні волокна, вовна, шкіра, целюлоза та ряд її похідних (нітроцелюлоза, ацетилцелюлоза, віскозний мідно - аміачний шовк, матеріали для лакових покрить), синтетичні смоли, пластмаси, натуральні та синтетичні каучуки, каучукоподібні та плівкотворні матеріали, синтетичні волокна (капрон, нейлон, лавсан та ін.), органічне скло – ось далеко неповний перелік високополімерів, які використовують у народному господарстві.
Не менше значення мають ці сполуки при виробництві продовольчих товарів. Білкові речовини: казеїн, желатин, альбумін та ін., а також крохмалисті речовини є основою харчування.
До ВМС відносяться речовини з молекулярною масою від декількох тисяч до декількох мільйонів, що складаються з сотень та тисяч атомів, зв’язаних один з одним силами головних валентностей. Макромолекули мають лінійчату структуру, а іноді з розгалуженням, яке може зв’язувати між собою ряд молекул, утворюючи сітчасту або трьохмірну структуру.
Внаслідок великих розмірів молекул ВМС дифузія у цих розчинах протікає дуже поступово, макромолекули нездатні проходити через напівпроникні мембрани. За цією властивістю, що найбільш характерна для типових колоїдів, ВМС відносили до колоїдів. Але порівняльна характеристика показала принципову різницю їх властивостей. Так, для колоїдних систем характерна поверхня розподілу, агрегативна та термодинамічна нестійкість; необерненість, процеси старіння, необхідність присутності третього компонента (стабілізатора), який адсорбується на поверхні розподілу часточок і запобігає коагуляції. Розчини ВМС термодинамічно стійкі системи (завдяки сольватним оболонкам розчинників), ліофільні, обернені, гомогенні, тобто однофазні системи. Розчини являються агрегативно стійкими без добавки спеціальних стабілізаторів. Тому Каргін В.О. та його співробітники довели, що розчини ВМС повинні бути віднесені до справжніх (молекулярних) розчинів.
Завдяки великій молекулярній масі вони нелеткі, нездатні переганятись, макромолекули під впливом механічної дії або окиснення порівняно легко розщеплюються, що приводить до значних змін властивостей полімеру.
Всі ВМС по своєму походженню можна розділити на дві групи: природні та синтетичні. Перші одержують біохімічним синтезом у результаті життєдіяльності організмів. До важливих природних сполук слід віднести: білки, нуклеїнові кислоти, полісахариди. Синтетичні полімери: синтетичні каучуки та волокна, пластмаси, лаки, органічне скло, іоннообмінні смоли. Одержують синтетичні полімери з низькомолекулярних речовин – мономерів – двома методами: полімеризацією та поліконденсацією.
Найбільш вдалою вважається класифікація органічних ВМС за складом основного ланцюга макромолекул. За цією ознакою ВМС розділяють на наступні три групи:
І. Карбоцепні, основні полімерні ланцюги їх побудовані виключно з вуглеводневих атомів:
а) полімери з насиченими ланцюгами, поліетилен:
... – СН2 – СН2 – СН2 – СН2 – СН2 –...
б) полімери з ненасиченими ланцюгами, полібутадієн:
... – СН2 – СН = СН – СН2 – СН2 – СН = СН – СН2 -...
в) полімерні спирти, полівініловий спирт:
... – СН2 – СН – СН2 – СН – СН2 – СН -...
 |  |  |
ОН ОН ОН
ІІ. Гетероцепні ВМС, полімерні ланцюги їх, окрім атомів вуглецю, містять також гетероатоми (O, N, S, P):
а) прості поліефіри, наприклад, полігліколі:
... – СН2 – СН2 – О – СН2 – СН2 – О -...
б) полімери, що містять у основному ланцюзі атоми азоту, поліаміди:
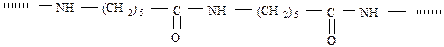
ІІІ. Елементорганічні, мають у основному ланцюзі макромолекули: Al, Si, Ti, Bo, Pb, Sb, Sn та ін.:
а) кремнійорганічні полісиланові сполуки:
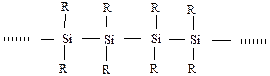
б) кремнійорганічні полісілоксанові сполуки, у основних ланцюгах є кремній та кисень:
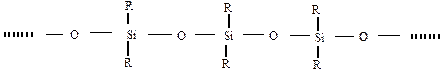
Механічні властивості, агрегатний стан, релаксаційні процеси у полімерах
Механічні властивості ВМС – одна з основних характеристик полімерів, що визначає їх цільове призначення та можливість застосування для виготовлення тих або інших напівфабрикатів та готових виробів. Ці властивості залежать від ряду причин і, у першу чергу, від довжини молекулярних ланцюгів (молекулярної маси).
Молекулярна маса полімеру є важливою характеристикою тому, що вона пов’язана безпосередньо з величиною молекули, з її довжиною. Зі збільшенням довжини макромолекули збільшується стійкість ниток, плівок, збільшується їх еластичність, зменшується розчинність, підвищується в’язкість розчинів, температура плавлення. Наприклад, поліізобутилен – важко зріджуваний газ, Тплав – 140,8 оС, молекулярна вага 56,1 щільність рідкого – 0,595; полімеризація 500 молекул – молекулярна маса 25000, медоподібна маса, її щільність 0,89, а коли молекулярна маса буде дорівнювати 50000, то це буде еластична речовина, що розтікається при лежанні і низькій механічній стійкості - 8 кг/см2.
Другий фактор – це природа атомів, що входять до складу молекул. Встановлено, що найбільш еластичні полімери, молекули яких складаються з атомів вуглецю та водню. Це обумовлено слабкістю взаємодії груп – СН2 – один з одним. Малий потенціальний бар’єр у таких полімерів (натуральний та синтетичний каучуки, поліізобутілен) забезпечує високу гнучкість їх ланцюгів, тому вони найбільш еластичні з усіх полімерів. Якщо у молекулі вуглеводня частину атомів водню замінити полярними замісниками (Br, Cl, OH, CN, COOH), то механічні властивості різко змінюються. Підвищується потенціальний бар’єр та збільшується твердість ланцюга. Наприклад, полівінілхлорид, полівінілацетат, целюлоза при кімнатній температурі – нееластичні.
Третій фактор, що впливає на механічні властивості ВМС – це міжмолекулярні сили. Потенціальний бар’єр молекул з полярними замісниками збільшується у результаті взаємодії атомів, що належать одній молекулі (внутрішньомолекулярна взаємодія), та атомів однієї молекули з атомами другої (міжмолекулярна взаємодія). Збільшення сил міжмолекулярної взаємодії підвищує твердість і знижує еластичність матеріалу. Особливо велика міжмолекулярна взаємодія у молекул, що містять групи – CONH2 (13200 кал/моль), - COOH (16200 кал/моль). Наприклад, у капрона, який по будові є поліамідом і містить амідну групу – - NH2. Ця група з сусідньою молекулою з такою ж групою утворює стійкий водневий зв’язок. Якщо у амідній групі атом водню замінити на групу – СН3, то між молекулами замість стійкого водневого зв’язку виникнуть більш слабкі вандерваальсові сили. У цьому випадку завдяки ослабленню міжмолекулярних сил потенціальний бар’єр зменшується, ланцюг стає більш гнучким, еластичним.






