У хімічній кінетиці всі реакції класифікуються за двома кінетичними признаками: за молекулярністю та за порядком.
Молекулярність реакції визначається числом молекул, одночасною взаємодією між якими відбувається елементарна хімічна реакція. За даною ознакою реакції бувають:
а) одномолекулярні (мономолекулярні) –перетворенню піддається одна молекула (реакції розкладу):
Br2 → 2 Br, тоді швидкість реакції:  .
.
б) двохмолекулярні (бімолекулярні) – сюди відносяться такі реакції, в яких взаємодія відбувається при зіткненні двох молекул різного або одного виду:
Н2+Cl2=2HCl, 2HCl=H2+Cl2
Кінетичне рівняння для таких реакцій має вигляд:
 .
.
в) трьохмолекулярні – у таких реакціях взаємодія між молекулами відбувається при одночасному зіткненні трьох молекул одного або різного виду:
2NO+H2=N2O+H2O.
Кінетичне рівняння для трьохмолекулярних реакцій:
 ,
,  .
.
Реакцій більшої молекулярності практично невідомо. Будь-яку складну реакцію можна уявити собі як певну кількість послідовних або паралельних простих реакцій.
Порядок реакції – визначають по більш формальній ознаці, ніж її молекулярність: по вигляду рівняння, що визначає залежність швидкості реакції (υ) від концентрації (С) реагуючих речовин.
Порядок реакції дорівнює сумі показників ступенів концентрації в рівнянні, що визначає залежність швидкості від концентрації реагуючих речовин. За порядком реакції бувають:
- першого порядку – відносяться реакції одномолекулярні, які мають кінетичне рівняння:
 .
.
Після перетворення та інтеграції це рівняння буде мати вигляд:
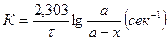 , де
, де
а – початкова концентрація речовини до реакції;
х – кількість г-молів речовини, яка прореагувала за час τ;
а-х – концентрація речовини в даний момент.
- другого порядку – відносяться реакції, кінетичне рівняння яких має слідуючий вигляд:
 .
.
- третього порядку – відносяться реакції, кінетичне рівняння яких має вигляд:
 .
.
Часто поняття молекулярність і порядок співпадають, але буває, що порядок реакції не співпадає з її молекулярністю. Це пояснюється: 1) більшість реакцій є сукупністю паралельних та послідовних реакцій; 2) у деяких реакціях один з реагентів знаходиться внадлишку.
Порядок реакції буває дробним, що характерно для реакцій які йдуть послідовно.
Реакції нульового порядку - це процеси, в яких швидкість реакції зберігається постійною у часі, тобто швидкість цих реакцій не залежить від концентрації речовин.
Кінетику процесів, визначення концентрації оптично активних речовин вивчають за допомогою поляриметричного методу аналізу.
Поляриметричний метод аналізу
Поляриметричний метод аналізу базується на вимірах, які пов’язані з явищем поляризації світла. За електромагнітною теорією в світловій хвилі коливання відбуваються у напрямку перпендикулярному направленню її розповсюдження, тобто світлові хвилі являються поперечними. У природньому світлі поперечні коливання відбуваються в усіх напрямках. Таке світло називається неполяризованим. Якщо поперечні коливання однонаправлені, відбуваються в одній площині, таке світло називається поляризованим. Площина, в якій відбувається коливання променя, називається площиною коливання, а площина перпендикулярна до неї називається площиною поляризації. При проходженні плоскополяризованого світла крізь розчин оптично активної речовини площина поляризації повертається на певний кут.
Поляриметричний метод аналізу заснований на залежності кута обертання площини поляризації від концентрації оптично активної речовини у розчині. Для цього вимірюють кут обертання площини поляризації променя світла, який пройшов крізь оптично активне середовище.
Оптична активність речовин зумовлена двома факторами: особливостями кристалічної решітки та особливостями будови молекул.
Оптично активні речовини бувають двох модифікацій. Правообертаючі, що обертають площину поляризації на певний кут вправо (за годинниковою стрілкою) і величиною обертання вважається позитивною. Лівообертаючі – обертають площину поляризації на певний кут вліво (проти годинникової стрілки) і величина обертання - негативна.
Кут обертання площини поляризації залежить від концентрації розчиненої речовини, товщини шару, крізь який проходить поляризоване світло, та від природи речовин, що виражається рівнянням:
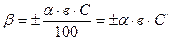 , де
, де
β- кут обертання площини поляризації;
α- питоме обертання площини поляризації;
в – товщина шару, см;
С – концентрація, г/100 мл;
С/ - концентрація, г/мл.
Якщо концентрацію виразимо моль/100 мл, то одержимо молярний коефіцієнт обертання площини поляризації:
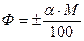 , де
, де
Ф – мольне обертання площини поляризації;
М- мольна маса, кмоль.
Величини α і Ф характеризують природу речовини, що досліджуємо. Знаки плюс та мінус показують, що обертання можуть відбуватися як вправо, так і вліво.
Питоме обертання площини поляризації дорівнює куту обертання (у градусах) цієї площини розчину, концентрація якого 1 г/мл оптичної речовини при товщині шару 10 см. Питоме обертання площини поляризації залежить:
1) від природи речовини;
2) від температури (з підвищенням температури α зростає);
3) від довжини хвилі (зі збільшенням довжини хвилі поляризованого світла α зменшується. Тому виміри проводять при постійній температурі.
Оскільки питоме обертання площини поляризації розчинів залежить від їх концентрації, то поляриметричний метод використовується для кількісного визначення оптично активної речовини.
Методи визначення концентрації оптично активної речовини
1. Якщо питоме обертання площини поляризації відомо, то вимірюють кут обертання β та із рівняння  вираховуємо концентрацію оптично активної речовини:
вираховуємо концентрацію оптично активної речовини:
 .
.
2. Якщо питоме обертання площини поляризації невідомо, то будують графік у координатах “кут обертання площини поляризації” – “концентрація”. Для цього готують ряд серій стандартних розчинів, знаходять кут обертання площини поляризації цих розчинів, будують графік. Потім вимірюють кут обертання площини поляризації оптично активної речовини з невідомою концентрацією та за графіком знаходять її концентрацію.
Кут обертання площини поляризації оптично активних речовин вимірюють на приладах поляриметрах. Як часний випадок, при дослідженні концентрації цукру в розчинах застосовують цукрометри. Основною частиною будь-якого поляриметра є поляризатор (джерело поляризованого світла) та аналізатор (прилад для дослідження цього світла).
Поляриметрія застосовується для визначення концентрації оптично активних речовин, для вивчення швидкості хімічних реакцій, де приймають участь оптично активні речовини, для їх ідентифікації.
ТЕМА: Розчини. Колориметрія
Розчинами називають двох - чи багатокомпонентні гомогенні системи, склад яких може змінюватися у широких межах.
Розчини можуть існувати у трьох агрегатних станах: газоподібному (повітря), рідкому та твердому (сплави металів).
Особливе значення мають водяні розчини. Всі природні води (морська, річкова, мінеральні джерела) являють собою розчини солей. Такі рідини, як кров, лімфа, соки рослин містять у розчиненому стані органічні та неорганічні речовини.
Речовина, яка при розчиненні не змінює свого агрегатного стану, називається розчинником, вона зазвичай присутня у розчині в більших кількостях.
Найважливішою характеристикою розчину є склад, який визначає розчин як у якісному відношенні (з яких компонентів розчин складається), так і у кількісному відношенні (в яких відносних кількостях той чи інший компонент міститься у розчині).
Існує багато способів виразу кількісного складу розчинів.
Кількість речовини, яка міститься у визначеній кількості розчину, називається концентрацією. Концентрація буває вагова та об’ємна.
Вагові види концентрації:
- процентна – показує кількість грамів розчиненої речовини в 100 г розчину:
 , де
, де
m – розчинена речовина, г;
m1- маса розчину.
- моляльна – показує число молів розчиненої речовини у 1000 г розчинника.
- мольна доля – показує відношення числа молів даного компоненту до суми молів всіх компонентів. Для двох компонентів:
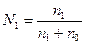 - мольна доля розчиненої речовини,
- мольна доля розчиненої речовини,
 - мольна доля розчинника.
- мольна доля розчинника.
Якщо мольну долю (виражається у грамах) помножити на 100, одержимо мольний процент.
Об’ємні види концентрації:
- нормальна (N) – кількість грам-еквівалентів речовини у 1000 мл розчину;
- молярна (М ) – кількість молів речовини у 1000 мл розчину;
- титр (Т) – кількість грам речовини у 1 мл розчину.
У розчинах речовини можуть знаходитись у різних ступенях дисперсності (тобто подрібненості). Розмір частинок є важливою ознакою, яка обумовлює багато фізико-хімічних властивостей розчинів. За розміром частинок розчини бувають:
- справжні (розмір частинок менше 1 ммк-10-7 см) – вони можуть бути (наприклад, NaCl, NaOH) іонні чи молекулярні (наприклад, розчини глюкози, гліцерину), що залежить від того, чи дисоціює, чи ні розчинена сполука;
- колоїдними – розмір частинок від 1 до 100 ммк.
Суміші з частинками більш 100 ммк утворюють завис (суспензії, емульсії).
Ідеальні розчини.
При змішуванні рідин, молекули яких неполярні та співпадають між собою за будовою, хімічними зв’язками та розміром молекул, теплові та об’ємні зміни дуже малі. Наприклад, при змішуванні толуолу та бензолу. Якщо при змішуванні двох рідин відбувається лише хаотичне розподілення частинок, тоді теплота змішування ∆Н=0, зміна об’єму не відбувається (∆V=0).
Суміші, в процесі утворення яких відсутні теплові та об’ємні ефекти, називаються ідеальними розчинами. Ідеальний розчин це є уявний стан. Реальні розчини можуть бути лише більш чи менш близькі до ідеальних розчинів. За деякими властивостями ідеальним розчинам близькі так звані безкінечно розбавлені розчини (мольна доля N«0,5). У них можна знехтувати взаємодією між частинками розчиненої речовини та взаємодією між частинками розчиненої речовини та розчинника.
На властивості розбавлених розчинів (ідеальних розчинів) впливають фактори:
- природа розчинника та розчиненої речовини;
- концентрація;
- температура (опосередкований вплив – при збільшенні температури концентрація зростає).
Розчини характеризуються наступними властивостями:
- тиск пари розчину нижчий тиску пари чистого розчинника;
- розчини замерзають при більш низькій температурі, ніж їх чисті розчинники;
- розчини киплять при більш високій температурі, ніж їх чисті розчинники;
- у розчинах спостерігається осмотичний тиск.
Розглянемо більш детально ці властивості.
У 1889 році французький фізик Рауль встановив залежність зниження тиску пари від концентрації розчину:
зниження тиску пари буде тим більше, чим більша концентрація розчиненої речовини.
Закон Рауля (його ще називають законом ідеальних розчинів) – відносне зниження тиску пари розчинника над розчином дорівнює мольній долі розчиненої речовини:
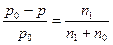 ; де
; де
р0 – тиск пари чистого розчинника,
р – тиск пари розчину,
р0 – р – абсолютне зниження тиску пари,
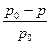 - відносне зниження тиску пари над розчином.
- відносне зниження тиску пари над розчином.
Цей закон Рауля правдивий лише для дуже розбавлених реальних розчинів неелектролітів.
Температура замерзання та кипіння таких розчинів залежить від тиску пари над розчином. Із закону Рауля витікає два наслідки.
Наслідок І – підвищення температури кипіння розчинів прямопропорційне його концентрації(С):
 , де
, де
∆tкип – підвищення температури кипіння розчину,
Кеб – ебуліоскопічна (з лат. Ebullio – закипати) константа (для води Кеб = 0,52).
Наслідок ІІ – зниження температури замерзання розчинів прямопропорційне їх концентрації (С):
 ,
,
Ккр – кріоскопічна (з грец. Kryos – холод) константа (для води Ккр = 1,86).
Ебуліоскопічна та кріоскопічна константи показують на скільки градусів розчин, який містить 1 моль речовини у 1000 г розчинника, вище закипає чи нижче замерзає, ніж чистий розчинник. Константи залежать тільки від природи розчинника.
Знання закону Рауля та його наслідків дозволяє за зниженням температури замерзання чи підвищенням температури кипіння розчинів знайти молекулярну масу розчиненої речовини та навпаки, знаючи молекулярну масу розчиненої речовини, знайти температури кипіння та замерзання розчинів.
Для визначення молекулярної маси розчиненої речовини концентрацію виражають через моляльну концентрацію (Сm). Якщо в А грамах розчинника розчинено n молів речовини, тоді:
 ,
,  , де
, де
g – наважка речовини,
М – молекулярна маса.
 ,
,
підставляючи цей вираз у формулу зниження температури замерзання, одержимо:
 , звідки
, звідки
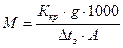 .
.
Дану формулу використовують для визначення молекулярної маси методом кріоскопії.
Осмотичний тиск.
У 1748 році А. Нолле спостерігав вперше, як розчинник проходить крізь мембрану з розбавленого розчину в більш концентрований. Односторонній перехід (дифузія) розчинника крізь напівпроникну мембрану з розчину з меншою концентрацією у розчин з більшою концентрацією (чи розчинника до розчину) називається осмосом. З цим явищем ми зустрічаємося при використанні великих концентрацій солі або цукру для консервації харчових продуктів. У цих умовах мікроорганізм стає нежиттєздатним, бо піддається плазмолізу (протоплазма витікає з клітини під дією осмосу).
Сила, яка зумовлює осмос, відношення до одиниці поверхні напівпроникнутої мембрани, називається осмотичним тиском. Отже, величина осмотичного тиску розчину визначається тим внутрішнім тиском, який потрібно прикласти до розчину, щоб осмос зупинився. Величину осмотичного тиску вимірюють в атмосферах або у мм рт. ст., у системі СІ - у паскалях (Па). Прилади, які вимірюють осмотичний тиск, називаються осмометри.
Використовуючи багаточисленні дослідні дані, голландський хімік Вант-Гофф довів (1887) використовування можливості застосування до розбавлених розчинів неелектролітів законів газового стану речовини (закони Бойля-Маріотта, Гей-Люссака, Авогадро). Тобто закони ідеальних розчинів добре підкоряються законам ідеальних газів. Вант-Гофф сформулював наступний закон: осмотичний тиск розбавленого розчину на напівпроникнуту мембрану дорівнює тому газовому тискові, який би спричиняла розчинена речовина, якщо б вона у вигляді газу при такій же температурі займала той же об’єм, що й розчин.
Виходячи з цього, до розбавлених розчинів неелектролітів може бути використано й рівняння Клапейрона-Мендєлєєва, яке об’єднує основні газові закони, за допомогою якого можна розрахувати осмотичний тиск.
 , де
, де
р – осмотичний тиск,
V – об’єм розчину,
n – число молів розчиненої речовини,
Т – абсолютна температура,
R – універсальна газова стала.
Тоді,  ,
, 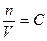 ,
,
де С - молярна концентрація (моль/л), звідки
 - закон Вант-Гоффа.
- закон Вант-Гоффа.
Це і є математичним виразом закону Вант-Гоффа.
Осмотичний тиск можна розрахувати й за зниженням температури замерзання чи за підвищенням температури кипіння. Припускаючи рівність моляльної (Сm) та молярної концентрацій (С) з рівняння:
 ,
,  ,
,
оскільки Сm ≈ С, то можемо записати:
 .
.
Підставляючи значення концентрації у формулу Вант-Гоффа, одержимо:
 .
.
Знаючи осмотичний тиск при заданій температурі, можемо визначити мольну масу розчиненої речовини.
 , де
, де
п - маса розчиненої речовини,
М – мольна маса.

Слід пам’ятати: все, про що ми говоримо (закони Рауля, Вант-Гоффа) відноситься лише до дуже розведених розчинів неелектролітів – ідеальних розчинів.
Властивості розчинів електролітів
Вивчення поведінки розчинів електролітів (речовини здатні проводити електричний струм) показало, що вони мають більш високе значення осмотичного тиску, ніж би за законом Вант-Гоффа для неелектролітів. Вони не підкоряються закону Рауля, та електропровідність електролітів зумовлюється тим, що їх молекули в розчинах і сплавах розкладаються на позитивно та негативно заряджені іони. Причина утворення іонів – взаємодія їх з молекулами розчинника (сольватація) чи окремий випадок - гідратація.
Таким чином, розчини електролітів містять мов би більше число частинок, ніж цього слід було б чекати. А це впливає на осмотичний тиск, температуру кипіння, температуру замерзання. Але Вант-Гофф встановив, що якщо у всі формули для ідеальних (чи обмежено розведених) розчинів ввести поправочний коефіцієнт і (ізотонічний коефіцієнт, чи коефіцієнт Вант-Гоффа), тоді ці закони будуть вірні й для розчинів електролітів.
і – це число, яке показує, у скільки разів величина осмотичного тиску, підвищення температури кипіння або зниження температури замерзання розчинів електролітів, знайдена дослідним шляхом, більше цих величин, розрахованих дослідним шляхом:
 .
.
Для пояснення властивостей розчинів електролітів шведський вчений С. Ареніус у 1887 році розробив теорію електролітичної дисоціації.
В розчинах сильних електролітів, згідно даної теорії електролітів діють електростатичні сили притягання між різнойменними іонами та сили відштовхування між однойменними. Біля кожного іону утворюється іонна атмосфера, яка складається з іонів протилежного знаку, кожний з іонів даної атмосфери знаходиться у колі іншої іонної атмосфери. Тому розчин сильного електроліту можна розглядати як систему рівномірно розподілених по всьому об’ємові різнойменних іонів, кожний з яких знаходиться у центрі силового поля, яке забудовується іонами, що його оточують. Це обумовлює досить складні взаємовідносини між компонентами розчину, які й впливають на його властивості.
Молекули сильних та слабких електролітів практично повністю дисоціюють, навіть у концентрованих розчинах (НСl, H2SO4, гідроксиди лужних, лужноземельних металів, солі) – сильні електроліти. Слабкі електроліти – H2CO3, H2SiO3, амфотерні гідроксиди.
Ступінь електролітичної дисоціації α - дорівнює відношенню кількості молекул n, які розклалися на іони, до загальної кількості розчинених молекул N:
 .
.
і – пов’язано зі ступенем дисоціації (ν – кількість іонів, на які дисоціює одна молекула електроліту):
 , звідки
, звідки
 .
.
Але міжіонна взаємодія не дуже розведених розчинів зменшує швидкість руху іонів, осмотичний тиск розчинів та інше. Це призводить до неправильного висновку, що в розчині міститься менше іонів, ніж у дійсності.
Тому, визначаючи ступінь дисоціації для таких розчинів електролітів знаходять не справжній, а уявний ступінь дисоціації, для цього замість справжньої концентрації іонів вводять поняття активність електроліту (або активність іонів у г-іон/л).
Активність (а) – виражає ефективну концентрацію дисоційованої частини електроліту з урахуванням міжіонної взаємодії. Відзначимо, що активність являє собою допоміжну, суто розрахункову величину. Зв’язок активності й концентрації виражається рівнянням:

 ,
,
де f – коефіцієнт активності.
При розрахунках осмотичного тиску, зниження температури замерзання, підвищення температури кипіння для розчинів сильних електролітів замість концентрації ставимо значення активності:
 ,
,
f – коефіцієнт активності, який представляє собою відношення активності до загальної концентрації, тобто:
 .
.
Величина f, як і активність, – різна; для досить розведених розчинів а = С, тоді f = 0, при збільшенні концентрації електроліту все сильніше проявляються міжіонні зв’язки, активність та коефіцієнт активності зменшується.
Фізичний зміст коефіцієнту активності у тому, що він показує вимір впливу міжіонних сил на властивість іону до хімічної дії. Якщо f < 1, то це означає, що іон не буде вступати у хімічну взаємодію. При f = 1 та а = С іон – хімічно активний.
Для характеристики залежності активності іонів від концентрації іонів, які знаходяться у розчині, Льюіс ввів поняття про іонну силу розчину електроліту.
Іонна сила розчину електроліту називається величина (μ), яка вимірюється напівсумою добутку концентрації (С) кожного з присутніх у розчині іонів на квадрат їх валентності (Z), тобто:
 ,
,
 .
.
Іонна сила представляє собою вигідний параметр, який виражає концентрацію всіх розчинених речовин, одночасно враховує їх молекулярну концентрацію (або моляльність), їх заряди.
Зі збільшенням концентрації розчину сильних електролітів кількість іонів у розчині зростає, що призводить до збільшення іонної сили й зменшення коефіцієнту активності й відповідно активності всіх іонів.
З вище сказаного слідує, що закономірності, виведені для слабких електролітів, не можуть використовуватися без відповідних виправлень до сильних електролітів.
Електропровідність розчинів. Кондуктометрія
Властивість речовини проводити електричний струм називається електропровідністю.
Розрізняють провідники І роду (метали, вугілля, графіт) – по них електричний струм передається потоком електронів, які направлені від катоду ланцюга до аноду. Така електропровідність називається електронною.
Провідники ІІ роду – розплави та розчини електролітів – по них електричний струм передається за допомогою іонів. Аніони у електричному полі рухаються до позитивно зарядженого електроду – аноду; катіони – до негативно зарядженого електроду катоду: так звана іонна провідність.
Швидкість іонів, які рухаються, мала в порівнянні зі швидкістю електронів у металах. Так, електропровідність міді та срібла приблизно у 1000000 разів більша електропровідності розчинів.
Для вимірювання електропровідності достатньо виміряти опір електричного току. Опір (R) залежить від довжини провідника l та площини поперечного перерізу провідника S й питомого опору (ρ - Ом∙см):
 , де
, де
ρ – опір провідника, який має довжину 1см та переріз 1см2 при постійній температурі.
За одиницю опору прийнятий Ом, який представляє собою опір стовпчика ртуті довжиною 106,3 см та площею перерізу 1 мм2 при 00С.
Для розчинів електролітів поняття опору замінюється уявою про електропровідність (L) величиною зворотною опору, тобто:
 .
.
Мірою електропровідності є кількість електрики, що виражена в кулонах, яка за одиницю часу проходить крізь електроліт.
Підставляючи у формулу визначення опору значення електропровідності, одержимо:
 .
.
Величина  , яка зворотна питомому опору, називається питомою електропровідністю χ (Ом-1 см-1):
, яка зворотна питомому опору, називається питомою електропровідністю χ (Ом-1 см-1):
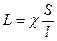
χ – (являє собою електропровідність 1 см3 розчину, що міститься між електродами площиною 1 см2,які знаходяться на відстані 1 см.
Питома електропровідність для чистої води дорівнює 3,84 · 10-8 Ом-1 · см-1 (це означає, що якщо ми опустимо у таку воду два електроди площиною 1 см2 кожний, тоді при відстані між електродами 1 см при різниці потенціалів 1 в сила струму буде дорівнювати 3,84·10-8). Якщо у воду потрапить лише трішки домішок, тоді питома електропровідність миттєво зросте.
Питома електропровідність залежить:
- від концентрації – по мірі зростання концентрації електроліту електропровідність спочатку росте (збільшується кількість іонів у розчині) й по досягненні максимуму починає падати, бо подальше розведення зменшує концентрацію іонів у одиниці об’єму;
- від індивідуальних властивостей іонів – від швидкості руху іонів, від заряду (чим він вищий, тим більше електрики переносить іон);
- від температури – при підвищенні температури швидкість іонів зростає, так як зменшується в’язкість середовища (збільшення температури на 10 викликає збільшення L ≈ на 2,8%).
Оскільки питома електропровідність залежить від багатьох факторів, то для зручності урахування впливу на електропровідність електролітів, їх концентрації та взаємодії між іонами було введено поняття про еквівалентну електропровідність. Еквівалентна електропровідність – це величина електропровідності розчину, який містить 1 г-екв електроліту, розташованого між електродами, що знаходяться на відстані 1 см один від одного.
Еквівалентна електропровідність (λ) дорівнює добутку його питомої електропровідності на об’єм розчину, який виражається у см3, який містить 1 г-екв:
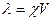 ,
,
V – розведення у см3/г-екв, зазвичай об’єм виражають у л / г-екв, тоді:
 .
.
λ – сильних та слабких електролітів зростає з розведенням та досягає максимуму при безкінечному розведенні, коли міжіонні сили взаємодії відсутні й катіони та аніони проводять електрику незалежно один від одного. У даному випадку еквівалентна електропровідність розчину (λ) дорівнює сумі електропровідності катіонів та аніонів (закон Кольрауша):
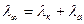 ;
;
λк та λа – називають рухливістю катіону та аніону й вони пропорційні абсолютним швидкостям іонів (uа та uк):
 ,
,
F – число Фарадея.
Розмірність еквівалентної електропровідності –Ом-1·см-1·см3 =Ом-1· см2. Pозбавлення - це величина, зворотна концентрації, тобто:
 , тоді еквівалентну електропровідність можна записати:
, тоді еквівалентну електропровідність можна записати:
 , де
, де
С – концентрація, яка виражається числом г-екв речовини в 1 л розчину.
Через електропровідність розчину можна визначити ступінь дисоціації електроліту при даному розбавленні:
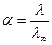 ;
;
λ- еквівалентна електропровідність при даному розбавленні (визначають експериментально),
λ∞ - еквівалентна електропровідність при безкінечному розбавленні, яка визначається за табличними даними як сума рухомих катіонів та аніонів (закон Кольрауша).
Вимірювання електропровідності розчинів називається кондуктометрією. Велике практичне значення має метод кондуктометричного титрування. Використовують наступні реакції:
- кислотно-лужної взаємодії (особливо широко використовується);
- комплексоутворення;
- осадження;
- окислення-відновлення.
Даний метод використовується при дослідженні каламутних чи забарвлених розчинів, де неможливо застосування індикаторів.
Метод заснований на присутність у розчинах кислот (чи лугів) високорухомих іонів Н+ (чи ОН-), які обумовлюють гарну електропровідність. При титруванні відбувається реакція нейтралізації та замість цих іонів накопичуються іони солей, які менш рухливі:
H+ + Cl- + Na + OH- → H2O + Na+ Cl-.
У момент, коли вся кислота (чи луг) буде нейтралізована еквівалентною кількістю лугу (чи кислоти), електропровідність розчину буде мінімальною. Додавання надлишку лугів (чи кислот) призводитиме до появи знову високо рухливих іонів ОН- (чи Н+) й електропровідність різко почне зростати. Визначивши за графіком кондуктометричного титрування точку еквівалентності, знаходимо відповідний об’єм титрованого розчину лугу, при цьому, знаючи об’єм досліджуваного розчину, розраховуємо концентрацію кислоти.

Т – точка еквівалентності.
Кондуктометрія застосовується для визначення вологості органічних розчинників, паперу, зерна, текстильних матеріалів. Так, для визначення вологості зерна деякий його об’єм засипають у мірну комірку між електродами та вимірюють опір даної проби. Чим більше вологості має зерно, тим меншим опором володіє. Зазвичай прилади градуюються у відсотках.
У харчовій промисловості кондуктометричне титрування використовують для визначення кислотності та лужності напівфабрикатів та готової продукції, особливо кислотність пива, соків, тіста та інше.
Більшість вимірювань електропровідності розчинів проводиться з використанням перемінного струму. Застосування постійного струму викликає явище поляризації, яке небажане (при перемінному струмі його напрямок змінюється ≈ 1000 разів за секунду та поляризація повністю зникає).
Визначення електропровідності електроліту проводиться за допомогою містка Уітстона та Кольрауша. Електроліт розташовують у спеціальному посуді з платиновими електродами (1). Джерело струму – індукційна котушка (4) чи високочастотний генератор (можна використовувати, якщо не потрібна висока точність та живлення від сітки з частотою порядку 50 періодів за секунду). Є також магазин опору – 2 та реєструючий прилад –3 (це біфілярний нуль-індикатор чи осцилограф). Реохорд ВD представляє собою проволоку, яка натягнута на метрову лінійку, на якій є рухомий контакт (С). Магазин опору підбирають так, щоб точка рівноваги була на середині реохорди (тоді помилка вимірювань мінімальна).

У наш час при вимірюванні електропровідності широко використовують реохордні мости (наприклад, Р – 38). В основі конструкції цих приладів також лежить місткова схема.
Спочатку роботи визначають постійну приладу  . Беруть розчин електроліту з відомою питомою електропровідністю (наприклад, KCl при t = 250, 0,01 н, χ = 0,001413 Ом-1см-1), а потім за допомогою приладу визначають опір розчину. Тоді за рівнянням
. Беруть розчин електроліту з відомою питомою електропровідністю (наприклад, KCl при t = 250, 0,01 н, χ = 0,001413 Ом-1см-1), а потім за допомогою приладу визначають опір розчину. Тоді за рівнянням  , знаючи χ та R, розрахуємо постійну приладу.
, знаючи χ та R, розрахуємо постійну приладу.
Колориметричний метод аналізу
Даний метод аналізу заснований на порівнянні якісної та кількісної зміни світлових потоків при їх проходженні крізь досліджуваний та стандартний розчини, називається абсорбційним спектральним аналізом. Він базується на вимірюванні послаблення світлового потоку, який відбувається внаслідок відбіркового поглинання світла визначеною речовиною. Розрізняють у абсорбційному спектральному аналізі:
- спектрофотометричні методи – які засновані на вимірюванні у монохроматичному світлі (світло з визначеною довжиною хвилі);
- фотометричні методи – засновані на вимірюванні не в суто монохроматичному пучкові світла.
У залежності від техніки виконання фотоколориметричні методи діляться на візуальні (суб’єктивні) колориметричні та фотоелектричні (об’єктивні). Колориметрія виконується “на око”, а фотоелектрично – фотоелементом. Однак, часто терміном колориметрія називаються всі методи визначення концентрації речовини у розчині за поглинанням світла.
Колориметрія – це фізико-хімічний оптичний метод аналізу, за допомогою якого визначають концентрацію досліджуваного забарвленого розчину.
Сутність методу: досліджуваний компонент розчину (простий чи складний іон, органічна сполука) за допомогою хімічної реакції переводять у забарвлену сполуку, а потім вимірюють інтенсивність забарвлення розчинника. Основними оптичними характеристиками забарвлених сполук у колориметричному методі є інтенсивність забарвлення та колір розчину.
Інтенсивність забарвлення характеризується величиною оптичної густини D. Існує залежність між світлопоглинанням (інтенсивністю забарвлення) та концентрацією поглинутої речовини. Цю залежність розкриває основний закон світлопоглинання (колориметрії) Бугера – Ламберта – Бера:
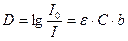 ;
;
I0 – інтенсивність падаючого на розчин світлового потоку,
I – інтенсивність світлового потоку, який пройшов крізь розчин,
C – концентрація розчину,
b – товщина шару розчину,
ε – молярний коефіцієнт світлопоглинання.
Молярний коефіцієнт світлопоглинання - величина постійна для розчинів даної речовини при проходженні світла з визначеною довжиною хвилі.
Величина молярного коефіцієнту світлопоглинання відповідає оптичній густині 1М розчину даної речовини при товщині шару (b) 1см. Ця величина залежить від: природи речовини, довжини хвилі падаючого світла та характеризує інтенсивність забарвлення даної речовини в розчині, а значить, чутливість фотометричної реакції. З рівняння Бугера – Ламберта – Бера видно, що чим більше значення молярного коефіцієнту, тим більш чутливіша реакція, тобто меншу кількість речовини (її концентрацію) можна визначити.
Залежність оптичної густини від концентрації речовини у розчині прийнято виражати графічно – на осі абсцис відкладають значення концентрації, а на осі ординат – величину оптичної густини.
З основного закону колориметрії (світлопоглинання):
 ,
,
при постійній товщині шару  маємо
маємо  . При графічному відображенні даної залежності одержують пряму лінію.
. При графічному відображенні даної залежності одержують пряму лінію.
 ,г/мл
,г/мл
При цьому готують ряд стандартних розчинів з відомою концентрацією та вимірюють на приладі (фотоелектроколориметрі) оптичну густину. Будують графік залежності. Потім вимірюють оптичну густину досліджуваного розчину та за графіком визначають його концентрацію.
Визначення концентрації в колориметрії проводять методом візуального порівняння інтенсивності забарвлення досліджуваного та стандартного розчинів. Зрівнювання проводять шляхом зміни товщини шару. Наллємо у вузький плоскодонний циліндр забарвлений розчин та будемо спостерігати інтенсивність забарвлення зверху при умові, що пучок світла падає на розчин знизу, крізь дно. Товщина шару b1, концентрація С1, тоді:
 .
.
Тепер збільшимо об’єм розчину у 2 рази, тоді товщина поглинаючого шару буде b2 та будемо знову зверху спостерігати інтенсивність забарвлення. Тоді для розбавленого розчину вже буде D2, b2 та C2:  . При розведенні концентрація зменшується в 2 рази, але частинок в об’ємі розчину на шляху світла, що проходить, залишилось сталим. Значить, доля поглинутого світла у другому випадку дорівнює долі поглинутого світла у першому випадку, тоді й оптичні густини будуть однакові: D1 = D2, тоді εb1C1 = εb2C2, звідси:
. При розведенні концентрація зменшується в 2 рази, але частинок в об’ємі розчину на шляху світла, що проходить, залишилось сталим. Значить, доля поглинутого світла у другому випадку дорівнює долі поглинутого світла у першому випадку, тоді й оптичні густини будуть однакові: D1 = D2, тоді εb1C1 = εb2C2, звідси:
 .
.
Наслідок: при однаковій інтенсивності забарвлення двох розчинів даної речовини їх концентрації зворотно пропорційні товщинам шарів, що поглинають світло. Можна з даного співвідношення знайти концентрацію досліджуваного розчину: 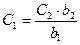 . Зрівнення за розчином відбувається шляхом зміни товщини шарів та використовується лише у візуальній колориметрії (суб’єктивний метод).
. Зрівнення за розчином відбувається шляхом зміни товщини шарів та використовується лише у візуальній колориметрії (суб’єктивний метод).
В об’єктивному методі аналізу для вимірювання оптичної густини використовують фотоелектроколориметри.
Фотоелектроколориметр (ФЕК) – це двохплечовий прилад (2 фотоелементи); фотоелементи з’єднані за принципом протитоку. Один з елементів знаходиться у контрольованому світловому потоці. В якості нуль-інструменту – гальванометр.
Світло від лампи (1) направлене на дзеркала (2, 2/), відображуючись від них, проходить світлофільтр (3, 3/) та потрапляє в кювети (4, 4/), потім крізь діафрагми, які з’єднані з вимірювальними барабанами (5, 5/) за допомогою призми (6, 6/) світлові потоки направляються на фотоелемент (7, 7/): 






