Для всіх дисперсних і колоїдних систем характерні дві основних ознаки: гетерогенність та роздробленість однієї з фаз, що називається дисперсною фазою. Гетерогенність у колоїдних системах характеризується наявністю поверхні розділу між частинками дисперсної фази і дисперсійного середовища. Поверхність одиниці об’єму частинок дисперсної фази називається питомою поверхнею дисперсної системи, яка дорівнює відношенню загальної поверхні частинок до загального об’єму роздрібненої речовини:
 ,
,
де Sпит – питома поверхня,
S – загальна поверхня частинок (поверхня розділу між фазами),
V – об’єм речовини дисперсної фази.
Чим менші частинки, тим більша питома поверхня системи. Якщо припустити, що всі частинки дисперсної системи - кулеподібні, то S і V будуть дорівнювати:
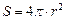 ;
;  ,
,
r – радіус окремих часток, тоді:
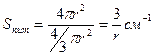 .
.
Питома поверхня дисперсної або колоїдної системи - величина окремих лінійних розмірів частинок дисперсної фази. Зі зменшенням розмірів частинок ступінь дисперсності збільшується. Явища, які відбуваються на поверхні поділу фаз, називаються поверхневими (концентрування енергії, адсорбція, змочування) і мають велике значення (збагачення корисних копалин, процеси змазки, поглинання шкідливих газів і водяних парів, одержання стійких емульсій, пін).
Усяка поверхня відрізняється за своїми фізико-хімічним властивостями від внутрішніх частин обох граничних фаз. Різниця ця полягає у тому, що на поверхні поділу фаз є надлишок вільної енергії. Цей надлишок енергії концентрується тому, що молекули на поверхні відчувають молекулярний тиск і для виштовхування їх із внутрішніх шарів на поверхню треба затратити роботу проти сил молекулярного зціплення.
Рівнодіючу для всіх молекул, що утворюють 1 см2 поверхні рідини, називають молекулярним або внутрішнім тиском. Внутрішній тиск для води дорівнює 15000 ат, для бензолу – 4000 ат. Щоб створити нову поверхню поділу, наприклад, розтягти рідину в плівку, треба виконати роботу проти сил міжмолекулярної взаємодії. Робота, витрачена на утворення 1 см2 поверхні розділу фаз, або еквівалента їй вільна енергія, що приходиться на 1 см2 поверхні, називається поверхневим натягом. Поверхневий натяг (s) вимірюється в ерг/см2. Під ним розуміють силу, яка діє на одиницю довжини лінії рідини.
Вільна поверхнева енергія визначається величиною поверхневого натягу та сумарного поверхневого розділу фаз і розраховується за рівнянням:
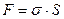 , де
, де
F – вільна поверхнева енергія,
σ – поверхневий натяг,
S – площа поверхні розділу фаз.
Чим більша сила молекулярної взаємодії, тим більший поверхневий натяг і молекулярний тиск. Молекулярний тиск не можна безпосередньо виміряти, тоді як методів вимірювання поверхневого натягу відомо декілька:
а) капілярного підняття рідини:
 , де
, де
h – висота підняття рідини у капілярі,
r – радіус капіляра,
d – щільність,
g – прискорення сили ваги.
Тоді  .
.
б) метод підрахунку крапель сталагмометра.
Вага краплі в момент відриву:
 ;
;
якщо краплі витікають з певного об’єму “n” крапель, то вага краплі буде дорівнювати:
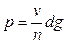 .
.
Тоді ми можемо записати рівняння:
 ;
;
 ;
;
 (для рідини):
(для рідини):
 (для води).
(для води).
Ділимо перше рівняння на друге:
 , звідки:
, звідки:  .
.
в) метод найбільшого тиску пухирців заснований на тому, що тиск Р, необхідний для проскакування пухиря повітря через капіляр, який занурений у рідину, прямо пропорційний поверхневому натягу:
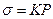 “К” залежить від радіуса (r) капіляра.
“К” залежить від радіуса (r) капіляра.
Для води:  ;
;  ,
,  .
.
Поверхневий натяг для води при 200С дорівнює 72,75 ерг/см2. Його можна зменшити, якщо розчинити у воді поверхнево-активні речовини (ПАР). Це органічні сполуки, у молекули яких входять одночасно полярні групи (-ОН; -СООН-; NH+4; -SO3H-) і неполярний вуглеводневий ланцюг. Прикладом можуть бути одноосновні кислоти і одноатомні спирти. Схематично молекулу зображають:
 , де
, де
 - полярна частина молекули,
- полярна частина молекули,
 - неполярна частина молекули.
- неполярна частина молекули.
ПАР використовують у сільському господарстві, побуті. Емульсії цих речовин використовують з метою зменшення випаровування вологи у фруктів, овочів, які після їх обробки зберігають свіжість, соковитість. Добавки ПАР до кормів збільшують приріст ваги с/г тварин на 18-29%. Передпосівна обробка насіння огірків підвищує урожайність на 20%. Добавки до бетону збільшують у 1,5 – 2 рази його стійкість, морозовитривалість, водонепроникність; добавки до хліба затримують черствіння. У побуті використовують ПАР у якості миючих та чистячих засобів. При розчиненні неорганічних речовин у воді поверхневий натяг незначно збільшується. Пояснюється це тим, що взаємне притяжіння між молекулами води і неорганічними іонами буде більше, ніж між молекулами води. Тому вони втягуються у середину з більшою силою.
Вивчення цього явища показало, що концентрація в середині і в поверхневому шарі не однакова. Зміна концентрації речовини на поверхні у порівнянні з концентрацією у середині фази називається адсорбцією. Адсорбція може проходити на межі рідина – газ, рідина – рідина, тверде тіло – газ, тверде тіло – рідина. Речовина, яка поглинає своєю поверхнею, називається адсорбентом (дерев’яне, кістяне вугілля, силікагель, активоване вугілля, яке одержують шляхом відповідної активізації вугілля – сирцю твердих порід дерева). У деяких випадках поглинання, що розпочинається на поверхні, поширюється на глибину адсорбенту. Такий процес носить назву абсорбція. Наприклад, поглинання водою аміаку. Якщо поглинання супроводжується хімічною взаємодією, такий процес називається хемосорбцією. Прикладом хемосорбції може бути поглинання вуглекислого газу або сірчистого газу натронним вапном [суміш NaOH + Ca(OH)2], яке поглинає їх та хімічно взаємодіє з ними. При хемосорбції вилучається багато тепла.
Загальний термін, що зв’язаний з поглинанням (адсорбція, абсорбція, хемосорбція), носить назву сорбція.
Відомо декілька теорій, що поясняють процес адсорбції.
Хімічна теорія Гуревича та Ленгмюра, основні положення якої слідуючі:
- адсорбція викликається валентними силами або силами залишкової хімічної валентності;
- адсорбція відбувається не на всій поверхні адсорбенту, а лише на активних центрах цієї поверхні.
Фізична теорія Поляні пояснює цей процес за рахунок міжмолекулярних ван-дар-вальсових сил.
У даний момент розглядають адсорбцію як складний фізико-хімічний процес. Вчені Н.О.Шилов, М.М.Дубінін встановили, що при різних випадках адсорбції відіграє роль фізична і хімічна взаємодії між адсорбентом і адсорбованою речовиною.
Процес, обернений адсорбції, називається десорбцією. При постійній температурі ці процеси зрівноважені:
 Адсорбція десорбція
Адсорбція десорбція

Адсорбція має вибірковий характер. Так, вугілля активоване поглинає хлор добре, але зовсім не адсорбує угарного газу (СО). Процес адсорбції екзотермічний, тому проводять його при низьких температурах.
Якщо концентрація у поверхневому шарі більша ніж у середині, то адсорбція буде позитивною, якщо менша, то від’ємна.
На межі рідина – газ існує залежність між поверхневим натягом та адсорбцією, яку встановив Гіббс:
 , де
, де
С – молярна концентрація;
Г – величина поверхневої адсорбції;
dσ – зміна поверхневого натягу, яка відповідає зміні концентрації Δ;
R – газова постійна;
Т – температура, К.
Якщо похідна буде мати знак “-”(при підвищенні концентрації поверхневий натяг зменшується), то адсорбція буде позитивна. Якщо з підвищенням концентрації поверхневий натяг збільшується, то похідна буде мати знак “+”, а адсорбція буде мати знак “-”. Таким чином, користуючись цим рівнянням, можна визначити знак адсорбції. Б.І.Шишковський вивів дослідним шляхом залежність поверхневого натягу від концентрації насичених жирних кислот у водних розчинах. Поверхневий натяг таких розчинів зменшується з ростом концентрації:
 (ВС + 1), де
(ВС + 1), де
s0 – поверхневий натяг води;
s - поверхневий натяг розчину з концентрацією “С”;
а – постійна для гомологічного ряду дорівнює:
 В – змінюється у гомологічному ряду, збільшуючись при переході до кожного вищого гомологу в постійне число разів (3-3,5 рази). Поверхнева активність речовин також збільшується при переході до кожного вищого гомологу в 3-3,5 рази. Ця залежність була сформована як емпіричне правило Траубе: “Збільшення довжини вуглеводневого радикалу в ефірних кислотах на групу – СН2 збільшує їх здатність до адсорбції в 3,2 рази, а поверхневий натяг у цю кількість разів зменшується”. Тверді тіла, як і рідини, мають певний запас вільної поверхневої енергії, яка згідно II закону термодинаміки може зменшитись до мінімального значення у даних умовах. Її можна знизити за рахунок адсорбції речовин, частинки яких мають силове поле меншої інтенсивності, ніж у частинок твердого тіла. Отже, на поверхні твердого тіла можуть адсорбуватись речовини, що знижують поверхневий натяг цього тіла. Тверде тіло може адсорбувати гази, пари рідини та розчинні речовини. Якщо розглядати адсорбцію за деякий проміжок часу, то спочатку швидкість адсорбції більша швидкості десорбції. По мірі протікання процесу швидкість адсорбції зменшується, швидкість десорбції збільшується. Це спостерігається до тих пір, доки обидві швидкості не зрівняються. Рівновага ця носить назву адсорбційної рівноваги, яка залежить від температури та концентрації. Підвищення температури зсуває рівновагу у бік ендотермічного процесу (десорбції). Залежність адсорбції від концентрації при постійній температурі можна зобразити графічно. Графік носить назву ізотерми адсорбції:
В – змінюється у гомологічному ряду, збільшуючись при переході до кожного вищого гомологу в постійне число разів (3-3,5 рази). Поверхнева активність речовин також збільшується при переході до кожного вищого гомологу в 3-3,5 рази. Ця залежність була сформована як емпіричне правило Траубе: “Збільшення довжини вуглеводневого радикалу в ефірних кислотах на групу – СН2 збільшує їх здатність до адсорбції в 3,2 рази, а поверхневий натяг у цю кількість разів зменшується”. Тверді тіла, як і рідини, мають певний запас вільної поверхневої енергії, яка згідно II закону термодинаміки може зменшитись до мінімального значення у даних умовах. Її можна знизити за рахунок адсорбції речовин, частинки яких мають силове поле меншої інтенсивності, ніж у частинок твердого тіла. Отже, на поверхні твердого тіла можуть адсорбуватись речовини, що знижують поверхневий натяг цього тіла. Тверде тіло може адсорбувати гази, пари рідини та розчинні речовини. Якщо розглядати адсорбцію за деякий проміжок часу, то спочатку швидкість адсорбції більша швидкості десорбції. По мірі протікання процесу швидкість адсорбції зменшується, швидкість десорбції збільшується. Це спостерігається до тих пір, доки обидві швидкості не зрівняються. Рівновага ця носить назву адсорбційної рівноваги, яка залежить від температури та концентрації. Підвищення температури зсуває рівновагу у бік ендотермічного процесу (десорбції). Залежність адсорбції від концентрації при постійній температурі можна зобразити графічно. Графік носить назву ізотерми адсорбції:
Г
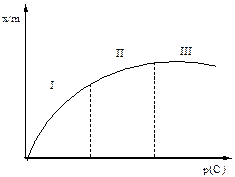 (моль/л)
(моль/л)
Рис. 1. Ізотерма адсорбції.
На ізотермі можна виділити три ділянки і зробити слідуючі висновки:
І - крутий підйом початкової частини ізотерми свідчить про те, що невелике підвищення концентрації адсорбтива на початковій стадії процесу супроводжується сильним ростом процесу адсорбції;
ІІ - подальше підвищення концентрації незначно гальмує процес адсорбції;
ІІІ - ріст адсорбції припиняється. Адсорбція досягає максимального значення і не залежить від концентрації.
Для виведення рівняння ізотерми адсорбції Ленгмора розглядаємо адсорбційну рівновагу з молекулярно – кінетичної точки зору. Молекулярну адсорбцію зображаємо у вигляді рівняння:

 Х+М ХМ.
Х+М ХМ.
Х – вільні точки на поверхні адсорбенту;
М – молекула адсорбтива.
Позначимо:
С – рівноважна концентрація;
Гmах – Г – концентрація вільних точок, тоді швидкість адсорбції, десорбції дорівнює:
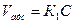 .
.
Залежність адсорбції від концентрації виражає рівняння Ленгмюра:
 .
.
Ці два рівняння застосовуються для І і ІІІ частини ізотерми. Для ІІ частини (або для середніх концентрацій) застосовується рівняння Фрейндліха:
 ;
;
“К” та “n” – емпіричні постійні;
х – кількість адсорбованої речовини;
m – кількість адсорбенту;
C – рівноважна концентрація адсорбтиву (моль/літр).
Постійні “К” і “n” знаходять на основі дослідних даних графічним шляхом:

Рис. 2. Графічне знаходження констант у рівнянні Фрейндліха.
Експериментальну величину адсорбції розчинних речовин на твердих адсорбентах вимірюють, розраховуючи концентрацію розчину до того, як він був у контакті з адсорбентом (С0 – моль/л) та після настання адсорбційної рівноваги (рівноважна концентрація Ср – моль/літр).
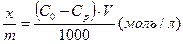 , де
, де
V – об’єм розчину (мл).
Величина адсорбції залежить від властивості твердої поверхні та природи розчинника. У цьому випадку треба відмітити властивість змочування. При нанесенні краплі води на тверду поверхню можливі слідуючі три випадки:
1. Крапля повністю розтікається по поверхні;
2. Крапля частково розтікається по поверхні і утворює з поверхнею гострий крайовий кут;
3. Крапля залишається на поверхні у вигляді кульки й утворює з поверхнею тупий крайовий кут.
Якщо крапля рідини розтікається по твердій поверхні або утворює з нею гострий крайовий кут, то це означає, що рідина добре змочує поверхню. Це характерно для рідин, які понижують поверхневий натяг (s) твердого тіла на межі з повітрям. Вода змочує мінеральні речовини з іонами або полярним зв’язком. Тверді поверхні, що добре змочуються водою, називають гідрофільними. Поверхня, на яких вода не розтікається й утворює з поверхнею тупий крайовий кут, називають гідрофобними. Це сажа, парафін, жири й інші органічні сполуки по відношенню до полярних рідин. Вони добре змочуються рідкими вуглеводнями.
Адсорбція розчинених речовин твердими адсорбентами підпорядковується одному загальному правилу: чим краще даний розчинник змочує поверхню адсорбенту, тим менша адсорбція молекул розчиненої речовини із даного розчинника на цій поверхні та, навпаки, якщо розчинник погано змочує дану поверхню, то адсорбція молекул розчинної речовини на ній буде велика. Для адсорбції речовин з водних розчинів використовують активоване вугілля, так як його поверхня гідрофобна, тому добре адсорбуються молекули розчиненої речовини. Використовують цей адсорбент для очистки водних розчинів спирту, цукру. Для адсорбції речовин з органічних розчинників використовують глину, силікагель.
На практиці іноді виникає потреба збільшити гідрофільність поверхні твердого тіла або і навпаки - підсилити його гідрофобність. Перший процес називають гідрофілізацією поверхні, другий – гідрофобізацією. З цією метою додають мила, жирні кислоти. Схематично ці процеси можна зобразити так:


Наприклад, тканини для виготовлення плащів обов’язково просочують гідрофобними речовинами (кремнійорганічними сполуками). Жирами обробляють поверхню різного інвентаря у кулінарії, кондитерському виробництві, хлібопекарському і т.д.
При гідрофілізації різні поверхні (шкіра рук, білизна, столовий посуд), внаслідок забруднення жировими речовинами втрачають властивості змочування. При обробці милами ці поверхні стають гідрофільними.
Адсорбція електролітів з розчину відіграє важливу роль у колоїдних, мікрогетерогенних системах. Іони електролітів адсорбуються в різній мірі і часто вибірково. Правила вибіркової адсорбції сформульовані Пєсковим і Фаянсом:
І правило: на всякій твердій поверхні будуть переважно адсорбуватись іони, що мають загальну з даною поверхнею атомне угруповання.
Полівалентні іони адсорбуються краще одновалентних. Майже незалежно від складу адсорбента іони однакової валентності адсорбуються по-різному, що зв’язане з їх розмірами та різною ступінню їх гідратації. Вони можуть бути розташовані у ряди, де кожний послідуючий іон адсорбується менше, ніж попередній:
Сs+ > Rb+ > K+ > Na+ > Li+;
CNS- > I- > NO3 - > Br- > Cl-.
ІІ. Згідно другого правила даний іон буде адсорбуватись твердою поверхнею, якщо заряд поверхні протилежний по знаку іону і якщо поверхнева сполука, що утворюється, буде важко розчинна. Іонна адсорбція не обернений процес. Розведення не викликає десорбції. З підвищенням температури вона збільшується, тому що діють хімічні сили.
В іонній адсорбції ми можемо спостерігати цікаве явище: обмінну адсорбцію іонів. Адсорбент поглинає з розчину іони одного знаку, тобто катіони або аніони, при цьому переходить з адсорбенту в розчин еквівалентна кількість іонів того ж знаку.
Можна ілюструвати слідуючими схематичними рівняннями:
 ;
;

 ХН+Na+ ХNa+H+
ХН+Na+ ХNa+H+
 ;
;
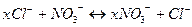 .
.
Х – активні точки на поверхні адсорбенту. Адсорбенти, які мають властивість поглинати обмінним шляхом іони з розчину, називають іонітами. Іоніти, поверхня яких заряджена від’ємно, адсорбують катіони (катіоніти). Іоніти, що мають позитивний заряд, адсорбують з розчину аніони і називаються аніонітами.
При вивченні кількісних закономірностей обмінної адсорбції велике значення має рівняння Нікольського:
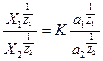 , де
, де
Х1,Х2 – рівноважні кількості адсорбованих іонів на одиницю маси адсорбента;
а1,а2 – активності іонів у рівноважному розчині;
z1,z2 – валентності іонів,
К – константа обміну.
Загальні закономірності іонообмінної адсорбції:
1. Здатність катіону входити у поверхню адсорбенту, витискуючи раніше поглинутий катіон, тим більше, чим вище валентність іону. У межах однакової валентності витискуюча здатність катіона тим більша, чим більше атомна вага, тобто чим менший гідродинамічний об’єм.
2. Здатність катіону бути витиснутим з поверхні адсорбента тим більша, чим менше його валентність, з іонів однакової валентності витискуються катіони з найменшою атомною вагою, тобто найбільшим гідродинамічним об’ємом.
Використовують іоннообмінну адсорбцію з метою очистки води для котлів теплових електростанцій. Воду можна не тільки пом’якшити, але й повністю демінералізувати. Ілюструвати цей процес можна такими хімічними реакціями:
1)  ;
;
2)  .
.
Для регенерації катіоніту його обробляють розчином хлориду натрію.
Процес обезболювання води зображують так:
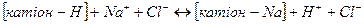

Процес адсорбції на твердій поверхні застосовують для поглинання цінних парів та газів, для очистки повітря, обезбарвлення та освітлення розчинів при виробництві цукру, глюкози, фармацевтичних препаратів, нафтопродуктів, освітлення м’ясних і рибних бульйонів (яєчним білком).
Іонообмінна адсорбція використовується при виробництві вина. За допомогою іонітів з нього видаляють Fe3+, Cu2+, Co2+, які викликають його помутніння. Змінюють сольовий склад молока (співвідношення казеїну та кальцію) при виготовленні іонітного молока.
Велике значення має процес адсорбції у хроматографічному аналізі, який вперше застосував для розділення складних речовин на складові частини ботанік М.С.Цвєт. Хроматографічний аналіз корисний для багатьох галузей знань і може вирішити слідуючі проблеми:
1. Розділити складну суміш на її компоненти;
2. Визначити ідентичність та однорідність хімічних сполук;
3. Кількісно визначити один або декілька компонентів складної суміші;
4. Визначити молекулярну структуру.
Метод заснований на рухові рідкої або газоподібної фази через нерухомий шар сорбенту, який має велику сумарну поверхню. Розділення відбувається за рахунок різниці в адсорбції або у кінетиці сорбції та десорбції. Для хроматографічного розділення суміші використовують різні механізми сорбції: адсорбційна хроматографія (молекулярна та іонна), осадкова, розподільча (паперова, колоночна, газо-рідинна). Теоретичною основою молекулярно-адсорбційної хроматографії є рівняння Ленгмюра, Фрейндлінха, ізотерма адсорбції.
Використовують органічні сорбенти: сахарозу, молочний цукор, целюлозу, крохмаль. Неорганічні сорбенти: Al2O3, CaCO3, CaO, силікогель (гель кремнієвої кислоти), штучні цеоліти – це кристали SiO2 + Al2O3 та одно або двовалентні метали.
Усі адсорбенти повинні мати добру селективність, відсутність каталітичної активності, бути хімічно інертними, мати гарну адсорбційну здатність, легко подрібнюватись. Найкращий розчинник повинен мати слабку адсорбційну здатність. Найчастіше – це малополярні рідини: бензин, бензол, сірковуглець. Для промивання хроматографа використовують ті ж рідини.
Прикладом молекулярно-адсорбційної хроматографії може бути дослід Цвєта. Для цього наносять петролійно-ефірний екстракт зеленого листа у колонку, заповнену Al2O3, промивають колонку бензолом. Розділення відбувається на a -, b - хлорофіл, ксантофіл і каротин. Ця хроматографія базується на адсорбованості речовин і різній швидкості пересування окремих зон, коли колонку промивають неводним розчинником.
Розділяють за допомогою цього виду хроматографії: алкалоїди, амінокислоти, вітаміни, гормони, вуглеводи, антибіотики та інше. Іоннообмінна хроматографія відбувається під дією сил електровалентного хімічного зв’язку. Сорбент – це не розчинна речовина, а сорбтив, знаходиться у розчині у дисоційованому стані. Сорбенти: катіоніти, аніоніти. Найчастіше використовують катіоніти: Al2O3, селікагель (гель H2SiO3 висушений, подрібнений), природні алюмосилікати. Аніоніти: Al2O3, гідроксид цирконію. Al2O3 як катіоніт розчиняють у NaOH і осаджують СО2, прожарюють.
Схема дисоціації:
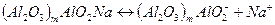 .
.
Схема іонного обміну:
 .
.
Для кожного іоніту всі іони металів розташовують у певний адсорбційний ряд за здатністю заміщати один одного. Al2O3 може бути використаний як аніоніт. Для цього катіоніт обробляють азотною кислотою:
 Іонний обмін відбувається за слідуючою схемою:
Іонний обмін відбувається за слідуючою схемою:
 .
.
Іоннообмінні сорбенти органічного походження є продуктами хімічної переробки вугілля або лігнину. Їх називають іоннообмінними смолами. Наприклад, фенолоформальдегідна смола, що має функціональну групу -  :
:
 .
.
Використовують цей вид хроматографії для очистки води, в аналітичній хімії, для вилучення залишків металів, очистки розчинів цукру, в медицині та харчовій промисловості.
Хроматографію також використовують для розділення іонів. Розділення речовин відбувається у результаті фільтрації досліджуваного розчину через колонку і утворенні та розчиненні при цьому осадів. Процес динамічний, повторюється багато разів.
Застосовують адсорбенти: Al2O3, CaCO3, силікогель, крохмаль + осаджувач.
Осаджувач – реагент, який утворює важкорозчинний осад з досліджуваною речовиною.
Для суміші аніонів (Cl-, CrO42-) реагентом може бути сульфат срібла. Білий осад (AgCl) утворюється зверху колонки, потім випадає оранжевий осад (Ag2CrO4). По розчинності важкорозчинні осади можна розташувати у ряд, який дозволяє вибрати осаджувач для розділення катіонів:
Cd(OH)2>Mn(OH)2>Nі(OH)2>,Zn(OH)2>Pb(OH)2>Co(OH)2>Cu(OH)2 (осаджувач Al(OH)3).
Для ряду сульфідів: MnS>FeS>ZnS>NiS>CoS>PbSCdS>>CuS (осаджувач Al2S3, Na2S).
Широко використовують осадову хроматографію для маркування сплавів. Кожний сплав має свою хроматограму.
Розподільча хроматографія базується на різному розподіленні речовин між двома незміщуючими речовинами. Теоретичною основою цього виду хроматографії є закон розподілення:
 ,де
,де
С – концентрація речовини у рухомому розчині,
С2 – концентрація речовини у нерухомому розчині,
К – коефіцієнт розподілення.
Чим більша різниця у коефіцієнті розподілення для різних речовин, тим краще їх можна відділити одну від одної, а потім кількісно визначити.
Носій просочують розчинником – це буде „нерухомий розчинник” (наприклад, водою просочують силікогель або хроматографічний папір). Другий розчинник, наприклад, хлороформ, який пропускають через колонку носія – це буде „рухомий розчинник”.
Нерухомі розчинники – це найчастіше полярні рідини: H2O, H2SО4, CH3OH. Рухомі розчинники – це менш полярні рідини, такі, як бензин, бензол, ацетон, чотирьоххлористий вуглець.
Суміш речовин розчиняють у рухомому розчині і вносять у колонку, яку промивають рухомим розчинником. У залежності від виду носія розподільча хроматографія може бути: паперовою, тонкошаровою, газорідинною.
Тонкошарова хроматографія є різновидністю розподільчої хроматографії. Розділення проводять на скляних пластинах, покритих окисом алюмінію, силікогелем та ін. Такий адсорбент утримує нерухомий розчинник. Нижній край такої пластинки занурюють у рухомий розчинник.
Розподільчу хроматографію використовують для аналізу газів. Такий вид хроматографії носить назву газорідинний. Розподілення речовин відбувається між газоподібною і рідкою фазами. Нерухомою фазою є рідина, яку наносять на інертний носій. Рухомою фазою є газ-носій, у якому міститься досліджувана суміш. При проходженні газо-носія через колонку відбуваються динамічні процеси розчинення і виділення газу в рідкій плівці.
Газом-носієм може бути: водень, гелій, аргон, азот, повітря, рідше вуглекислий газ.
Вимоги до рідин як нерухомої фази такі: повинні бути хімічно інертні, високо селективні, мати малу в’язкість, незначну летючість, добре утримуватись на поверхні твердого носія. Можна використовувати вазелінове масло, високо кипляче авіаційне масло, високо вакуумні змазки. Тверді носії, що застосовуються, - це каолін, силікогель, активоване вугілля, пемза, різні марки високо пористої цегли.
Техніка проведення хроматографічного аналізу складається з трьох основних етапів:
1. Підготовка хроматограм та реактивів;
2. Одержання хроматограм;
3. Аналіз хроматограм.
Для кількісного визначення точної концентрації речовин часто використовують спектрофотометрію, колориметрію.






