1. Коагулопатии — в основе патогенеза лежит нарушение свертывающей системы крови (гемофилия и др.).
2. Тромбоцитопатии — заболевания обусловлены нарушением образования и состава тромбоцитов (болезнь Верльгофа и др.).
3. Вазопатии — в основе патологии лежит поражение сосудистой стенки (болезнь Шенлейна-Геноха и др.).
Гемофилия
Гемофилия — один из видов коагулопатии — это врожденное заболевание, в основе длительной (от нескольких часов до нескольких дней) кровоточивости которого лежит нарушение свертывающей системы крови.
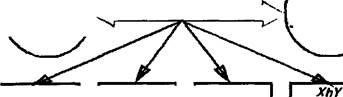
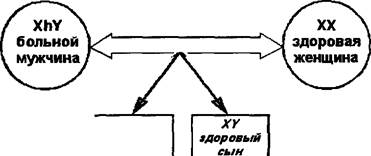
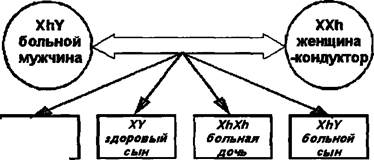
Этиопатогенез. Заболевание передается по наследству внуку от деда через здоровую мать ребенка, являющуюся кондуктором (=переносчиком) гемофилии. Болеют только представители мужского пола. Однако возможны некоторые исключения: если мама является кондуктором гемофилии, а отец болеет этим заболеванием, то их дочь тоже может заболеть гемофилией.
Следует отметить, что наследственность заболевания (рис. 178) установлена только в 1/2-3/4 части случаев.
В патогенезе заболевания лежит нарушение первой фазы свертывания крови: наличие у больного антигемофильных факторов в количестве меньше нормы нарушает образование плазменного тромбопластина, что приводит к удлинению (=замедлению) времени свертывания крови, в результате чего происходит продолжительное кровотечение.
Выделяют 3 основные формы гемофилии в зависимости от преобладающего недостатка одного из антигемофильных факторов:
- гемофилия А (= классическая) — дефицит VIII фактора (=антигемо-фильного глобулина А); наиболее частая форма — 80% от общего количества больных;
- гемофилия В — дефицит ГХ фактора (=плазменного тромбопластиново-го компонента=фактора Кристмаса — имя больного); частота —10-15%;
- гемофилия С — снижение активности XI фактора (=плазменного предшественника тромбопластина=фактора Розенталя); частота 3-5%.
Таким образом, в основе гемофилии лежит нарушение механизма вторичного внутреннего гемостаза.
XY
здоровый VX1 мужчина
xx
здоровая дочь
XXh дочь- кондуктор
XY здоровый сын
XXh женщина кондуктор/
больной сын
XhX дочь-кондуктор
XXh Дочь-
КОНДУКТОР
Рис. 178. Варианты наследования гемофилии. Обозначения: XX — женский половой набор хромосом, XY — мужской половой набор хромосом, Xh — Х-хромосома
с геном гемофилии
Клинические признаки у большинства больных появляются в раннем детском возрасте, очень редко у взрослых лиц. Жалобы, внешние признаки и данные объективного осмотра при всех видах гемофилии одинаковы:
- кровотечения из остатка пуповины у новорожденного;
- кровотечения у детей грудного возраста при прорезывании зубов, у старших — при их удалении:
- кровотечения при незначительном травмировании кожи (стрижка, ушиб, царапины);
- кровотечения из слизистых оболочек носовых ходов, ротовой полости, желудочно-кишечного тракта, мочевыводящих путей, что может привести к постгеморрагической анемии;
- гемартрозы, для которых характерны увеличение объема и болезненность суставов, могут сопровождаться гипертермией. Неоднократные гемартрозы, когда кровь полностью не рассасывается, приводят к деформации суставов, развитию контрактуры (ограничение движений в суставе), анкилоза (полная неподвижность в суставе) и инвалидности детей;
- синяки и гематомы — это результат кровоизлияний в коже, подкожной клетчатке, мышечной ткани и в забрюшинном пространстве.
Для течения гемофилии характерна периодичность — т.е. периоды обострения (возникают они совершенно неожиданно, могут быть даже на фоне терапевтической профилактики заболевания) сменяются разными по длительности периодами ремиссии (от нескольких недель до нескольких лет).
Заболевание в детском возрасте часто приобретает тяжелую форму с высокой смертностью (до 75%). После 20 лет отмечается облегчение клинических признаков и более редкое возникновение обострений.
Диагностические показатели лабораторного обследования:
1) удлинение времени свертывания крови (по Ли-Уайту — от нескольких десятков минут до нескольких часов);
2) удлинение времени рекальцификации плазмы;
3) уменьшение в плазме антигемофильных факторов.
Внимание! Анализы первичного гемостаза (количество тромбоцитов, показатель ретракции кровяного сгустка и др.) и тромбиновое время v больных гемофилией в пределах нормы. Уважаемые студенты! При изучении анализов, характерных для всех видов геморрагических диатезов, свяжите патогенез заболевания и механизм соответствующего гемостаза.
Болезнь Верльгофа
(=идиопатическая тромбоцитопеническая пурпура)
В разных источниках медицинской литературы до сих пор болезнь Верльгофа (немецкий врач XVIII века) — одна из многих тромбоцитопатии — имеет много названий. Во втором указанном названии внимательным студентам сразу стали ясными следующие моменты патологического процесса заболевания: в патогенезе главным фактором является тромбоцитопения, а основным клиническим признаком — пурпура. Т.е. в основе болезни Верлыофа лежит на рушение одного звена первичного гемостаза, а именно — тромбоцитов.
Этиопатогенез. Причина болезни Верлыофа в данное время остается до конца не известной. По этиологии существует две формы заболевания (в отечественной практике идиопатическая тромбопитопеническая пурпура — общее название группы заболеваний):
1) наследственная (очень редкая):
2) приобретенная, которая по разным современным теориям разделена еще на 2 формы:
- первичная (а теорий этиологии опять несколько):
• нарушение костного мозга в виде замедленного созревания мегака-риоцитов и отшнуровки тромбоцитов;
• задержка тромбоцитов и их повышенный гемолиз в селезенке;
• иммунная теория, согласно которой антитромбоцитарные аутоан-титела как разрушают тромбоциты в крови, так и патологически влияют на процесс отшнуровки в костном мозге;
- вторичная — возникновению тромбоцитопении способствуют вирусные инфекции, интоксикация разного генеза, эндокринные и психологические нарушения, лекарственные препараты (особенно прививки), пищевые и прочие факторы.
Однако, независимо от этиологии, главным изменением в составе крови при болезни Верлыофа является уменьшение количества тромбоцитов — тромбоцитопения. Как указано выше, одновременно с этим происходит снижение функции тромбоцитов относительно эпителия сосудов.
Отсюда вытекают следующие клинические признаки патологического процесса:
- возникающие на любой поверхности кожи и видимых слизистых оболочках геморрагии (кровоизлияния) имеют следующие характерные признаки:
• асимметричные:
• полиморфные — разных размеров (от петехий до экхимозов);
• полихоомные (не одного цвета) — так как геморрагии возникают одна задругой в разное время, то одновременно их цвет в зависимости от длительности бывает от красно-бордового (свежие) до сине-зеленого и желтого (через несколько дней); кожа приобретает характерный вид — «кожа леопарда» (англ. leopard);
- кровотечения:
• из слизистых оболочек носа, полости рта, мочевого пузыря, желудочно-кишечного тракта, легких, почек и др.;
• у старших девочек обильные маточные кровотечения;
- могут быть кровоизлияния в головной мозг, плевру, сетчатку глаз.
Диагностические показатели лабораторного обследования (рис. 172 В):
1) тромбоцитопения (может быть до нескольких единиц);
2) удлинение времени кровотечения по Дюке (10-20 мин. и больше);
3) удлинение или отсутствие ретракции кровяного сгустка;
4) нарушение показателей ААФТ;
5) положительные пробы на выявление резистентности капиллярной стенки;
6) при значительном кровотечении развивается постгеморрагическая анемия — уменьшение показателей эритроцитов и гемоглобина.
Болезнь Шенлейна-Геноха (-геморрагический васкулит)
Болезнь Ш енлейна-Геноха (немецкие врачи ХГХ века) — одна из вазопа-тий. Основной механизм заболевания — воспаление и поражение стенок капилляров и мелких сосудов в виде повышенной проницаемости. По современным данным, в основе геморрагического васкулита большое значение имеет нарушение тромбоцитарного и коагуляционного звеньев системы свертывания крови. А проявляется заболевание нарушением звена первичного гемостаза, а именно — стенки артериол. прекапилляров. капилляров и всиул (паиваскулит).
Этиопатогенез до сих пор остается до конца не установленным. Предполагается, что повреждение сосудистой стенки происходит под влиянием инфекционных процессов, так как болезнь Шенлейна-Геноха чаще всего развивается через 2-4 недели после ангины, ОРВИ, отита или других инфекционных заболеваний. Реже заболевание проявляется на фоне пищевой и лекарственной аллергии. Таким образом, патогенез геморрагического васкулита носит инфекционно- или токсико-аллергический характер, когда на стенках сосудов оседают иммунные комплексы и повреждают их.
Через сосуды с возникшей при этом повышенной проницаемостью в окружающие ткани проходят плазма и эритроциты.
Клинические признаки. У детей геморрагический васкулит наблюдается чаще, нежели у взрослых лиц. В зависимости от места поражения выделено 4 основных синдрома заболевания:
1) кожный синдром — обязательным клиническим признаком являются геморрагии на коже, для которых характерны:
- вид сыпи — чаще петехии (может быть пятнисто-папулезная сыпь);
- симметричность возникновения;
- место возникновения — чаще вокруг суставов, особенно голеностопных, на разгибательных поверхностях конечностей и ягодицах;
- одновременное возникновение всей сыпи и потому все геморрагии одного цвета (сначала красные, через несколько дней переходят в желтый цвет);
- часто для сыпи характерно волнообразное течение — через несколько дней, а иногда и через 2 недели после первой сыпи появляются новые элементы свежей геморрагии;
2) суставной синдром нередко возникает одновременно с кожным синдромом, поэтому называется еще кожно-суставным — обычно поражаются голеностопные, коленные и лучезапястные суставы, в которых возникает боль, отечность и гиперемия кожи; процесс непродолжительный — 2-3 дня;
3) абдоминальный синдром, в патогистологии которого лежат кровоизлияния в стенку кишечника и брыжейки, напоминает клинику «острого живота»:
- приступообразная боль в брюшной полости — ребенок неспокойный, мечется; для боли не характерна локализация, а наоборот — миграция (т.е. меняется место ее расположения, как в виде жалобы, так и при пальпации);
- больной принимает вынужденное положение — прижимает ноги к животу или находится в коленно-локтевом положении;
- рвота, может быть с кровью;
- понос, тоже может быть с кровью;
- бледное, страдальческое (англ. suffer) выражение лица;
- сухой, обложенный белым налетом язык:
4) почечный синдром, возникающий обычно на 2-4 неделе патологического процесса. В анализе мочи почечный синдром проявится:
- гематурией (эритроциты в моче);
- протеинурией (белок в моче).
Иногда кровоизлияния в головном мозге приводят к:
- судорогам;
- общему менингеальному синдрому.
Процесс в целом чаще имеет благоприятный исход.
Патогномоничных лабораторных данных при болезни Шенлейна- Геноха нет.
Все показатели, указывающие на количество и качественную полноценность тромбоцитов, а также анализы вторичного гемостаза при болезни Шенлейна-Геноха всегда находятся в пределах нормы. Это является обязательным дифференциально-диагностическим признаком и профессиональной помощью врачу при такой форме геморрагических диатезов. А положительными могут быть только пробы на резистентность капиллярной стенки.
В общем анализе крови бывают умеренный лейкоцитоз с небольшим сдвигом влево и повышение СОЭ.
Лейкоз
Лейкоз (с греческого leukos — белый) — это опухоль, возникающая из кроветворных клеток, с обязательным поражением костного мозга и вытеснением нормальных ростков кроветворения.
Синонимами слова «лейкоз» являются старые термины: лейкемия (предложена в середине XIX века на основе характерного для заболевания гиперлейкоцитоза) и белокровие. В данное время эти определения почти не применяются, так как при разных видах лейкоза количество лейкоцитов может быть разнообразным и, кроме того, изменяться могут не только белые, но и красные форменные элементы.
Точно этиология лейкоза до сегодняшнего дня не установлена. Известно, что заболевание чаще возникает при:
- рентгенологическом облучении;
- ионизирующем излучении (вспомните об атомных взрывах в Хиросиме и Нагасаки, после которых в 10-20 раз увеличились опухолевые заболевания по сравнению с другими городами Японии);
- продолжительном приеме цитостатических иммунодепрессантов;
- влиянии радиоактивных и некоторых химических веществ (бензол). Исследователями замечена наследственная склонность к заболеванию. Классификация. Все лейкозы делятся на 2 группы: острые и хронические.
Внимание! Основой такого деления является не обычное правило — продолжительность заболевания, а нарушение характера кроветворения и состав клеток крови.
При остром лейкозе происходит патологическая пролиферация и задержка развития малодиФФеренцированньгх. молодых, т.е. бластных клеток, которые и составляют основную массу опухолевых клеток. Конкретное название острого лейкоза происходит от названий нормальных предшественников опухолевой клетки (лимфобласты, миелобласты, мегакариобласты и др.) — лимфоб-ластный лейкоз (наиболее частая форма у детей), миелобластный лейкоз, ме-гакариобластный лейкоз и тд. Форма лейкоза из морфологически неиденти-фицированных бластных клеток называется недифференцированной.
У детей острый лейкоз наблюдается чаще хронического.
При хроническом лейкозе происходит повышенная пролиферация незрелых стадий и сохранение их дифференцирования до зрелых клеточных элементов. Основную массу опухолевых клеток составляют морфологически зрелые клетки (лимфоциты при лимфолейкозе, моноциты при моноцитар-ном лейкозе, эритроциты при эритремии и т.д.).
Кратко рассмотрим острый лейкоз (в целом).
Патогенез: системное опухолевое разрастание исходит из кроветворных клеток — костного мозга. Эти изменения сопровождаются геморрагическим синдромом, некротически-язвенным и дистрофическими процессами, инфекционными осложнениями.
Клиника заболевания. В течении острых лейкозов выделяют:
- первый острый период;
- ремиссию;
- рецидивы.
К сожалению, до сих пор никому не удалось найти специфических, присущих началу лейкоза внешних признаков. Симптомы носят общий характер: слабость, быстрая утомляемость, недомогание (англ. indisposition), иногда одышка, тахикардия, головокружение (в связи с анемией), субфеб-рильная температура. Может быть увеличение лимфатических узлов. Неконкретные признаки скрывают опасный патологический процесс.
Нередко заболевание начинается из ангины, катара верхних дыхательных путей, пневмонии.
Более характерными являются признаки, появляющиеся в острой стадии:
- боль в костях (чаще поражаются трубчатые кости, их диафизы, особенно бедренная и большеберцовая);
- боль в суставах (одновременно может быть припухлость тканей и покраснение кожи в области суставов);
- болезненность костей при поколачивании, что связано с инфильтрацией тканей лейкозными клетками;
- значительное диагностическое значение имеет симптом стерналь-гии — болезненность при постукивании г рудины.
А затем происходит стремительное разрастание симптоматики лейкоза:
- высокая лихорадка;
- обширная картина геморрагического синдрома — кровоизлияния от петехий до больших размеров — в кожу, подкожную клетчатку, в головной мозг, под конъюнктиву глаз; значительные кровотечения из слизистых оболочек. Признаки геморрагического диатеза обусловлены нарушением всех 3 факторов гемостаза — тромбоцитопенией, поражением сосудистой стенки (лейкемическая инфильтрация) и нарушением свертывающей системы крови;
- язвенно-некротический процесс полости рта, зева, кишечника (в связи с лейкозной инфильтрацией тканей и сосудов, последующим присоединением инфекции и снижением защитной функции организма);
- все более выраженная анемия (бледность кожи и слизистых оболочек). Кроме того, при полном объективном осмотре выясняются следующие
признаки и возможн ые осложнения тяжелого патологического процесса:
- увеличение лимфатических узлов, пальпаторно чаще безболезненные, реже болезненные — обычно шейные, подчелюстные, подмышечные, паховые; может быть так называемый симптомокомплекс Микулича (немецкий хирург ХГХ-ХХ века) — лейкозная инфильтрация в ткани слюнных и слезных желез;
рентгенологически определяется увеличение лимфатических желез средостения;
- сердце: может быть миокардиодистрофия на фоне анемии, а также лейкозная инфильтрация, некрозы и кровоизлияния в сердечной мышце; при этом перкуторно — границы расширены, аускультатив-но — тоны глухие, систолический шум; может развиться перикардит;
- пульс — малый, тахикардия;
- АД резко снижено;
- легкие — пневмония с лейкозной инфильтрацией и очагами некроза;
- экссудативный плеврит;
- увеличение печени, селезенки разной степени, чаще в более поздней стадии патологического процесса; при пальпации плотные, безболезненные;
- нервная система — признаки лейкозного менингоэнцефалита.
Лабораторные данные
(во время разгара заболевания)
Костно-мозговой пунктат:
- увеличение числа бластных клеток до 70-100% клеточных форм;
- снижение числа эритронормобластов, клеток гранулоцитарного ряда и мегакариоцитов.
Общий анализ крови (рис. 172 Г):
- эритропения (может быть до 1-1,5 Т/л);
- снижение гемоглобина (даже до 20-30 г/л);
- тромбоцнтопения (бывает ниже критического уровня);
- количество лейкоцитов может быть разным — от лейкопении (в начале заболевания) к значительному гиперлейкоцитозу (даже выше 100 Г/л);
- основной состав лейкограммы — лейкозные бластные клетки, число которых может достигать 100%;
- лейкемический провал (!!!) — патогномоничный признак;
- повышение СОЭ.
Примеры описания результатов общего осмотра и обследования ребенка в истории болезни 1. Мальчику 7лет.
На коже нижних конечностей, больше на разгибательных поверхностях, в участках голеностопных суставов большое количество петехиалъной и пурпурной сыпи, симметричной, красного цвета. Определяются гиперемия, отек и незначительная боль при пальпации голеностопных и коленных суставов.
Манные лабораторного обследования.
Общий анализ крови: Эр. — 4,2 Т/л. НЪ — 128 г/л. Тромб. — 180 Г/л. Л. — 9,6Г/л. СОЭ — 12мм/час.
Проба щипка — положительная, проба жгута — 10-12. ААФТ— в пределах нормы.
Время капиллярного кровотечения по Дюке — Змин. Ретракция кровяного сгустка — 22 часа.
Лабораторные тесты вторичного гемостаза — в пределах нормы. Диагноз: Геморрагический васкулит.
Жалобы на слабость, повышенную утомляемость, головную боль, «мушки» перед глазами, плохой аппетит, тахикардию при физической нагрузке.
Кожа и слизистые оболочки очень бледные, сухие. ЧСС — 100 в 1 мин. Аус-культативно на верхушке тоны сердца ослаблены, нежный систолический шум. АД — 90/60мм рт. ст.
Данные лабораторного обследования.
Общий анализ крови: Эр. — 2,8 Т/л. НЬ — 72г/л. ЦП— 0,77. Ретикулоциты — 15%о.
Диагноз:Железодефиццтная анемия Пет.
УХОД ЗА РЕБЕНКОМ
Обшие правила ухода:
- соблюдение режима — при малейших признаках кровоизлияний и кровотечений ребенок находится на строгом постельном режиме.
Несоблюдение режима со стороны ребенка часто наблюдается при геморрагическом васкулите, когда самочувствие больного может быть удовлетворительным; такие дети требуют особого наблюдения медперсонала. Переход на постельный и так далее режим выполняется только по назначению врача;
- транспортировка больных — на руках, на каталке, кресле;
- соблюдение правил кормления и диеты;
- постоянное наблюдение за состоянием ребенка и срочное сообщение врачу о возникшем ухудшении.
Доврачебная помощь при носовом кровотечении:
- психологическ и успокоить больного:
- положение — полусидячее, голова несколько запрокинута назад;
- методика:
• на переносицу положить кусочки льда, завернутые в марлю или ткань, смоченную холодной водой;
• плотно прижать крылья носа к носовой перегородке (на 5-6 минут и больше);
• иногда эффективно перед сжатием крыльев носа голову ребенка 5-6 раз наклонить в его полусидячем положении вперед и вниз;
• при неэффективности перечисленных мер делается тампонада носовых ходов — дыхательные пути заполняются турундой, смоченной перекисью водорода (Н202);
• медсестра может дать 1 ч. л.-1 ст. л. 10% раствора кальция хлорида;
- срочное с ообщение врачу.
Правила ухода при кровоизлияниях в суставах:
- режим — строгий постельный:
" транспор тировка — на каталках, на руках;
- обеспечить неподвижность^^иммобилизацию) суставов - забинтовать на лонгете.
ОСНОВЫ ИММУНОЛОГИИ
Согласно предложению отечественного академика Р.В.Петрова (1982 год), понятие «иммунитет — это способ защиты организма от живых тел и веществ, несущих на себе признаки генетической чужеродности».
Следовательно, иммунитет — это возникновение реакции в организме с целью защиты его от инфек ционных агентов и других генетически ин о родных веществ, которые проникли в организм извне (англ. from without) или образовались в нем самом.
Иммунная система — это самостоятельная система, отличающаяся от таких же самостоятельных (дыхательная, сердечно-сосудистая и др.) следующими особенностями:
- она распространена по всему телу:
- клетки этой системы постоянно циркулируют по организму в системах лимфо- и кровообращения:
- она способна образовывать специфические молекулы антител (иммуноглобулинов) в зависимости от особенностей поступившего антигена; связь между ними называется антигеннослъю.
ОРГАНЫ ИММУННОЙ СИСТЕМЫ
Органы иммунной системы разделены на 2 группы:
- центральные=первичные;
- периферические=вторичные.
Центральные органы иммунной системы
1. Вил очковая железа (=тимус) — источник Т-лимФоцитов. Железа закла-дывается на 6 неделе внутриутробного развития, лимфоциты в ней появляются на 2-3 месяце жизни плода.
После рождения железа является относительно зрелым органом, состоящим из двух долей, окруженных капсулой: корковые перегородки от капсулы разделяют доли на дольки.
Под капсулой находится корковое вещество, в котором имеется много малых лимфоцитов, обладающих значительной митотической активностью. Мозговое вещество тимуса складывается, в основном, из ретикулярных клеток и местами из компактных скоплений эпителиальных клеток, подвергающихся уплощению, — телец вилочковой железы (телец Гассаля — английский врач ХГХ века). Лимфоцитов в мозговом веществе мало.
Около 90% лимфоцитов разрушается в самом же тимусе, а остальные 10% под влиянием гормонов вилочковой железы созревают и приобретают иммунную функцию. Окончательно созревает тимус в 12-15 лет. После этого начинается возрастная, так называемая физиологическая инволюция — снижается образование гормонов, цитопоэз, а также уменьшается сама зона коркового вещества.
К сожалению, кроме возрастной, необратимой инволюции, под влиянием разнообразных действий (антибиотики, экологические факторы, стрессовые состояния) может развиться так называемая акцидентальная (обратимая) инволюция тимуса. Такое развитие событий особенно опасно в раннем детском возрасте. Оба вида инволюции могут привести к развитию вторичной иммунологической недостаточности.
Если возрастная инволюция не наступает, что бывает редко, то при этом возникает дефицит гормональной функции надпочечников. Все это приводит к тяжелому течению воспалительных процессов, а также увеличению частоты злокачественных заболеваний.
2. У птиц (!!!) - бурса Фабрициуса (итальянский анатом XVI-XVII века). Относительно мысли об аналоге бурсы у человека ученые разделились на 2 группы:
- большинство считает, что таким является костный мозг;
- некоторые предполагают, что роль бурсы выполняет лимфоидный аппарат кишечника.
В костном мозге клетки гемопоэза появляются на 12-14 неделях внутриутробного развития. На 20 неделе мозг является источником стволовых клеток миело- и лимфопоэза. До конца беременности они образуются лишь в костном мозге.
Периферические органы иммунной системы
После созревания и получения иммунной компетенции в указанных центральных органах лимфоциты поступают в циркулирующее русло (кровь, лимфа), а потом в периферические лимфоидные органы. К главным из них относятся следующие.
1. Лимфатические узлы. Закладываются на 3-4 месяцах внутриутробного развития, а заканчивается их образование в первые месяцы жизни ребенка.
Строение лимфатического узла аналогично строению тимуса — он состоит из капсулы, перегородок (трабекулы). коркового и мозгового вешест-щ (последнее заканчивается в ножке узла). В корковом веществе имеется большое количество фолликул, содержащих лимфоциты, макрофаги, ретикулярные и дифференцирующиеся клетки (= центр размножения фолли-кул). В мозговом веществе фолликул мало.
Афферентные лимфатические сосуды входят в узел на уровне коркового вещества, эфферентные выходят из его ножки (рис. 178 А).
I. Корковое вещество
Фолликул (с доминирующими В-клетками)
• болезнь Брутона бактериальная инфекция лимфома
II. Паракортикальная зона (Тимус-зависимая) (с доминирующими Т-клетками)
СПИД
вирусные, грибковые и паразитарные инфекции ■ новообразования
Совместная гипофункция фолликул и паракортикальной зоны приводит к тяжелой комбинированной иммунологической недостаточности (англ. SCID — Severe Combined Immuno Deficiency)
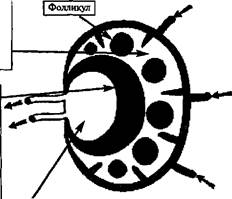
III. Мозговое вещество (с доминирующими плазматическимим клетками) Основные патологические изменения:
доброкачественный и злокачественный гистоцитоз
Макрофаги и фибробласты имеются во всех I-III слоях
Рис. 178 А, Структура лимфатического узла и его патологические состояния (гипофункция или отсутствие функции клеток соответствующего слоя приводят к развитию определенного заболевания)
Функции лимфатических узлов очень разнообразные:
- иммунопоэтическая — образование плазмоцитов и синтез антител;
- гемопоэтическая — образование лимфоцитов;
- барьерно-Фильтрационная — задержка чужеродных структур и злокачественных клеток;
- стимулирующее действие на размножение клеток различных органов:
- обменная — разрушение эритроцитов, участие в обмене гемоглобина, белков, жиров и витаминов.
2. Селезенка. Закладывается на 5 неделе внутриутробного развития; заканчивается созревание через несколько лет после рождения. Общее строение аналогично приведенным выше структурам тимуса и лимфатических узлов.
Гистологические особенности:
- перегородки селезенки пронизаны венами:
- вены открываются в синусы:
- синусы соединены с аотеоиолами:
- сеть из большого числа артериол, окруженная лимфоцитами, — это лимфатический узелок селезенки.
Главные функции селезенки:
- иммунологическая функция — образование Т- и В-лимфоцитов, лим-фобластов, которые через синусы попадают в систему кровообращения;
- поддержка резистентности организма к инфекционным антигенам (синтез антител);
- поддержка гомеостаза.
3. Лимфатическая ткань желудка и кишечника. Закладывается на 9-15 неделях, заканчивается ее образование после 20 недели внутриутробного развития. Это организованная лимфоидная ткань, расположенная вдоль поверхности желудка и кишок (имеются изолированные лимфоидные фолликулы, а на всем протяжении тонкой кишки имеются сгруппированные фолликулы, т.е. нейеровы бляшки (Пейер — швейцарский анатом XVII-XVIII столетий) — их у детей 3-14 лет всего около 100), червеобразного отростка. К этой группе относятся мезентериальные (брыжеечные) лимфатические узлы.
Основные функции:
- синтез антител:
- участие в дифференцировании лимфоцитов:
- создание иммунитета слизистых оболочек:
- создание толерантности к пищевым продуктам.
4. Миндалины кольца Вольдейеоа-Пирогова. Закладываются на 22 неделе жизни плода, а развиваются к периоду полового созревания. Складываются в основном из ретикулярной ткани. Лимфоидная ткань представляет собой фолликулы. В миндалинах имеются Т- и В-лимфоциты, плазмоциты.
5. Слизистая оболочка желудочно-кишечного тракта и бронхов также содержит лимфатическую ткань (англ. MALT — Mucus associated lymphatic tissue и BALT — Bronchus associated lymphatic tissue).
В иммунном ответе организма на чужеродное вещество принимают участие два взаимосвязанных звена:
- врожденный неспецифический (естественный) иммунитет;
- приобретенный специфический (адаптивный) иммунитет.
ВРОЖДЕННЫЙ НЕСПЕЦИФИЧЕСКИЙ (ЕСТЕСТВЕННЫЙ) ИММУНИТЕТ
Антигены (=иммуногены) могут попадать в организм человека, проникая (англ. penetrate) через кожу, уши, слизистую оболочку глаз, носа, рта. По химическому строению большинство антигенов белкового происхождения. Они гибнут под влиянием различных факторов: антибактериального действия, соляной кислоты желудочного сока или спустя некоторое время отторгаются (англ. tear a|way) из дыхательных путей при чихании, кашле и т.п.
Такая первичная линия защиты организма называется неспецифические Факторы зашиты=неспепифическая резистентность. Неспецифическая резистентность является Филогенетически наиболее древней. Она первой развивается в онтогенезе и первой действует при необходимости защиты детского организма. Обнаруживаются факторы защиты на коже, слизистых оболочках, в лимфе и сыворотке крови.
Неспецифические факторы разделяют на такие группы:
1) механические барьеры и физиологические факторы;
2) биохимические и химические реакции;
3) гуморальный компонент;
4) клеточный компонент.
1. Действие механических барьеров и физиологических факторов заключается в препятствии (англ. obstaclei проникновению инфекционных агентов в организм ребенка. К ним относятся:
- неповрежденная кожа;
- в виде покрова (англ. cover) — устойчивая слизистая оболочка дыхательных путей, глаз и органов пищеварения;
- кашель, чихание, рвота, понос, выделение мочи, пота, слюны, слез, слу-шивание кожи — все это механически удаляет микроорганизмы;
- физически микрофлору убивают: повышение температуры тела, гормональный баланс.
2. Развитие инфекции подавляют многие биохимические и химические реакции. Например:
- антигены гибнут под влиянием соляной кислоты желудочного сока и мочи (имеет слабокислую реакцию);
- антимикробным действием обладают жирные кислоты в сальных железах;
- Гр(+) флору разрушает фермент лизоцим, который имеется во многих секретах организма.
3. Гуморальный компонент. К этому компоненту врожденного иммунитета относятся следующие факторы.
Естественные антитела сыворотки крови. Их действие — активация системы комплемента и разрушение в первую очередь Гр(-) микроорганизмов.
Система комплемента — это комплекс белков, взаимодействие (англ. interaction) в работе которых вызывает выделение специальных компонентов, выполняющих такие главные функции:
- участие в воспалительных реакциях (для этого выделенные из комплемента компоненты выделяют из базофилов крови и тучных клеток
биологически активные вещества — гистамин, серотонин, брадики-нинидр.);
- опсонизируюшая Фу нкция (термин «опсонизация» означает процесс присоединения к микроорганизму разнообразных молекул) — это выделение специальных, так называемых опсонизируюших компонентов, покрывающих антигены и иммунные комплексы, что приводит к усилишю_Ф^цтл]ццоза;
- цитотоксическая (=литическая) — одним из последних компонентов комплемента является МАК (мембраноатакующий комплекс), действующий в виде атаки на мембрану патогенной флоры, что приводит к ее разрушению.
Активность системы комплемента наиболее низкая у новорожденного ребенка, но уже в 1 месяц она равна активности взрослого человека. Недостаточное количество комплемента приводит к развитию:
- повышенной чувствительности к инфекционным заболеваниям (пневмония, сепсис);
- болезней крови и сосудов (васкулит Шенлейна-Геноха);
- злокачественной патологии;
- отеков кожи, нарушений функции дыхательных путей (обструктив-ный синдром, ДН), кишечника (диспептические расстройства — рвота, диарея).
Пропердин. Количество его у новорожденного незначительное, а к концу 1 недели жизни увеличивается до уровня взрослого человека.
Главное биологическое действие пропердина заключается в активации системы комплемента.
Лизоцим. Его количество у новорожденного больше, чем у взрослого человека. Лизоцим — это термостабильный фермент, обладающий лизирую-щим действием, в первую очередь на Гр(+) микрофлору. Он имеется в лейкоцитах, плазме крови, слизистом секрете носа, слезах, слюне и в других жидких средах организма.
Интерферон уже у новорожденного ребенка при необходимости образуется в значительном количестве. Однако в конце грудного периода этот процесс не такой активный. В дальнейшем при ежегодном увеличении достигает максимального уровня в старшем школьном возрасте.
Интерферон синтезируется в первую очередь лейкоцитами и макрофагами. Продуцируют интерферон также Т- и В-лимфоциты, эндотелиальные и эпителиальные клетки.
Действие интерферона:
- противовирусное:
- противоопухолевое:
- антипаразитарное:
- антибактериальное:
- усиливает фагоцитоз:
- повышает образование антител.
Лактоферрии и трансферрии связывают железо, необходимое клеткам бактерий.
Лейкины (образуются при распаде лейкоцитов), плакины, В-лизины (выделяются при разрушении тромбоцитов) — действуют на Гр(+) флору.
4. Клеточный компонент.
Основными участниками клеточного компонента являются:
- мононуклеарные фагоциты (моноциты, тканевые макрофаги);
- гранулоциты — нейтрофилы, эозинофилы и базофилы.
Одним из главных клеточных факторов является система фагоцитоза — наиболее древняя форма неспецифической защитной реакции организма. Смысл слова «фагоцитоз» такой — захватывание и поглощение чужеродного м атериала, его раздун/енИР И вы вед ение из организма, обычно антигенов больших размеров (бактерии, вирусы, частицы коллоида и др.). Формируется система на 5-25 неделях внутриутробного развития.
Главную роль в процессе фагоцитоза выполняют:
- макрофаги (=А-клетки иммунитета, «А» от латинского adhaesivus—липкий) — большие (10-25 нм) мононуклеары, относящиеся к моноцитам. Макрофаги представляют собой активно фагоцитирующие клетки и со д ержащие внутриклеточные Ферменты длл пепеьартлния погло щенного материала, а также имеющие аппарат для синтеза этих Ферментов.
В костном мозге имеется 1,5% зрелых моноцитов, в периферической крови их до 10%. Из циркулирующей системы моноциты быстро попадают через капилляры в ткани (55% — в печень, 15% — в легочную ткань, до 10% — в брюшную полость), где превраща ются в зрелые тканевые макрофаги. Количество последних в тканях в 400 раз больше, чем в кровеносном русле.
Тканевые макрофаги обладают ненаправленной функцией миграции и функцией продвижения по направлению к объекту, который вызвал их активацию, т.е. хемотаксисом.
- микрофаги — это нейтрофильные гранулоциты.
Таким образом, макрофаги и микрофаги составляют основную форму МФС.
Порядок фа го цитоза микроорганизмов слецУюшиЛ:
- активация фагоцитирующих клеток в ответ на появление антигена;
- хемотаксис:
- адгезия — прикрепление к антигену;
- затем антиген поглощается (англ. absorption) в цитоплазму Фагонита. что приводит к образованию вакуоли:
- заканчивается процесс лизисом (т.е. перевариванием) поглощенного объекта.
Если лизис не происходит, то микроорганизмы размножаются в фагоцитах, что вызывает гибель последних. Это приводит к развитию так называемой персистенции — задержке циркуляции микрофлоры в организме ребенка.
Процесс фагоцитоза микроорганизмов на первый взгляд кажется простым. Активность его к рождению ребенка равна активности взрослого человека. Однако хорошо развита у новорожденных только стадия поглощения, а стадия лизиса развивается у малыша постепенно на протяжении 1 полугодия жизни. Кроме того, некоторые микроорганизмы (пневмококки, Hemophilus influenzae, Klebsiella pneumoniae) устойчивы даже к процессу фагоцитоза, а такие возбудители, как стафилококк и гонококк, активно размножаются в фагоцитах. Этим объясняется высокая частота пневмоний, тяжелое их течение, частое возникновение осложняющих синдромов у детей раннего возраста.
Кроме рассмотренного процесса фагоцитоза, тканевые макрофаги способны продуцировать большое количество биологически активных веществ — питокинов. К ним относятся:
- опухоленекротизируюший — Фактор некроза опухоли (ФНО):
- интерлейкин-1 (старое название — эндогенный пироген) — имеет важное значение в развитии специфического и неспецифического иммунитета;
- комплемент:
- интерферон и др.
Одновременно с моноцитами и тканевыми макрофагами в осуществлении клеточных реакций врожденного иммунитета принимают участие гра-нулоциты. Частично они участвуют в процессе фагоцитоза. Кроме того, гранулоциты выполняют такие функции:
- нейтрофилы — хемотаксис, секреция (например, выделившиеся из них протеазы способны активировать свертывающую и антисверты-вающую системы крови);
- эозинофилы — хемотаксис, а также способствуют уничтожению гельминтов больших размеров, которые не поддаются процессу фагоцитоза;
- базофилы крови и тканевые базофилы (=тучные клетки) — хемотаксис: одновременно базофилы — это основное депо гистамина. гепарина и сеоотонина.
Нормативные пок азатели факторов несиеии«1ического иммунитета — см. «Приложения №6».
ПРИОБРЕТЕННЫЙ СПЕЦИФИЧЕСКИЙ (АДАПТИВНЫЙ) ИММУНИТЕТ
Приобретенный специфический (адаптивный) иммунитет осуществляется лимфоцитами. Краткий этап образования клеток иммунитета — лимфоцитов — такой:
Родоначальник — родоначальная стволовая клетка (костный мозг)
♦
Лимфоидная стволовая клетка
Предшественник Т-клеток
Предшественник В-клеток
Т-лимфоциты (образуются в тимусе)
В-лимфоциты (образуются в костном мозге)
Затем Т- и В-лимфоциты покидают вилочковую железу и костный мозг и расселяются в Т- и В-зонах периферических органов иммунной системы. Расселяющиеся лимфоциты называются зрелыми покоящимися (покой — англ. rest, peace) клетками, готовыми к иммунному ответу.
Специфический иммунитет разделяют на 2 типа:
- клеточный — выполняют Т-лимфоциты;
- гуморальный — представлен В-лимфоцитами.
Клеточный иммунитет
Т-лимфоциты, выполняющие клеточный иммунитет, образуются в ви-лочковой железе. Этому способствуют эпителиальные клетки и гормоны тимуса (тимозин, тимопоэтин, тимулин и др.). Процесс происходит последовательно по ходу перемещения из наружного слоя железы (коркового) во внутренний (мозговой) слой.
Из тимуса Т-лимфоциты поступают в кровеносное русло и в периферические лимфоидные органы. Т-лимфоциты в периферической крови составляют 55-75%, в селезенке — 60%, в лимфатической железе — 70% от общего количества лимфоцитов. Они относятся к долгоживущим клеткам. Некоторые лимфоциты существуют около 15-20 лет.
По современным данным. Т-лимфоциты, в зависимости от состава молекулы гликопротеинов (CD4 и CD8) на их поверхности, разделяют на 2 большие категории:
- Т-лимфоциты-хелперы/индукторы (=СБ4+лимфоцит) (от англ. help — помогать);
- Т-лимфоциты-киллеры/супрессоры (=С08+лимфоцит) (от англ. kill — убивать, suppressor — угнетатель).
Известно, что зрелые Т-клетки могут иметь только один из этих белков — или CD4, или CD8. А незрелые лимфоциты в тимусе могут содержать одновременно CD4 и CD8. Количество Т-лимфоцитов-хелперов и Т-лим-фоцитов-киллеров/супрессоров в периферической крови составляет соответственно 55-60% и 20-30%.
На проникновение чужеродных тел в организм в первую очередь реаги-рую т Т-лимфо1шты-хелдеры/индукторы — происходит связывание антигена с рецепторами на поверхности Т-клеток. Образованный антиген-рецептор-ный комплекс отрывается от Т-хелпера и фиксируется поверхностными рецепторами макрофага.
Макрофаг перерабатывает антиген из корпускулярного вида в молекулярные факторы стимуляции В-лимфоцитов. Далее антиген передается В-лимфоцитам, которые под влиянием антигенной стимуляции и (!!!) активирующего действия Т-хелперов/индуктор ов превращаются в плазмоциты. Последние синтезируют молекулы иммуноглобулинов, которые связываются с антигеном и инактивируют его.
Для лучшего запоминания этого процесса представлен следующий рисунок клеточной кооперации иммунного ответа:
Антиген k I—.______ I Пре"
вра-
Ан?геи к IАнтиген L
Т \ Рецептор >v
Рецептор 1^ Рецептор "Ч
Т-хелдер макрофаг |В-л
ще-
нне _ _ Инагпшцш
|В-лнмфоцйт]—»^ Плязмоцит [-^-[Сиитез Ig| >-
Кроме того, Т-хелперы после контакта с антигеном вырабатывают специальные вещества, стимулирующие Т-киллеры/супрессоры. В некоторых случаях Т-хелперы сами могут выполнять киллерную функцию.
В целом главными функциями Т-лимФ^чштоь-хе^пегхчг/иидуклчпх'в является помощь:
- В-клеткам превращаться в плазматические клетки;
- Т-лимфоцитам-киллерам/супрессорам превращаться в зрелую цито-токсическую клетку;
- макрофагам осуществлять эффекты гиперчувствительности замедленного типа. Вспомним! Типичным примером гиперчувствительности замедленного типа является туберкулиновая проба. Введение туберкулина вызывает гиперемию и отек, достигающие максимума через 24-48 часов после введения антигена, когда образуется гиперемированпая папула и некроз в центре. Некротизированная ткань отторгается, после чего участок изъязвления медленно заживает. Гистологически в участке обнаруживаются макрофаги и лимфоциты. Двойное название второй группы Т-лимфоцитов — Т-лимфоциты-килле-ры/супрессоры — обусловлено тем, что эти клетки могут дифференцироваться как в Т-киллеры, так и в Т-супрессоры. Функции у них разные. Т-лимфоциты-киллеры:
- выполняют цитотоксическую функцию — осуществляют лизис мишеней (англ. target), разрушают вирусы и опухолевые клетки;
- обеспечивают генетическое постоянство внутренней среды организма. Механизм цитолитического действия Т-лимфоцитов-киллеров состоит
из 3 этапов:
1) первый этап=программирование лизиса — между клеткой-киллером и клеткой-мишенью устанавливается специфический контакт;
2) второй этап=летальный удар — клетки-киллеры литически действуют на клетки-мишени;
3) третий этап=заключительный — происходит разрушение клетки-мишени.
Клетка-киллер после 2 этапа (!!!) отделяется от мишени и в 3 этапе участия не принимает. Поэтому один Т-лимфоцит-киллер может без «личного» повреждения, сохраняя «собственную» активность разрушить несколько клеток-мишеней.
По результатам последних исследований, Т-лимфопиты-супрессоры как самостоятельные морфологические клетки, возможно, не существуют. Однако доказано, что некоторые Т-клетки «специально» притормаживают иммунный ответ в организме, а именно — подавляют (=супрессируют) образование антител. Установлено, что чрезмерная (англ. excessive) реакция на антигены может привести к образованию антител большего количества, нежели нормальное, и к развитию аутоиммунного заболевания.
Со временные мет ч -ы лиагностики состоянии клеточногоиммунитета 1.Указанная выше туберкулиновая проба.
Трактовка анализа. Положительный тест является показателем нормальной функции Т-клеток. Однако следует отметить, что (-) тест не оценивается, как показатель недостаточности клеточного иммунитета. В первую очередь это относится к детям раннего возраста (еще отсутствует сенсибилизация к туберкулину).
Тест с диагностической целью проводится и другими препаратами.
2. Количество лимфоцитов (возрастные нормативные показатели) и Т-клеток в кровеносном русле. Количество Т-клеток у детей 7-14 лет составляет
- абсолютное число = 1400 кл/мкл;
- они составляют 70% от всех лимфоцитов.
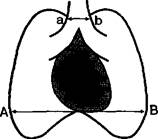
Обозначения: ab — ширина сосудистого пучка в месте бифуркации трахеи;
АВ — ширина грудной клетки на уровне купола диафрагмы
Трактовка анализа: уменьшение указанных цифр является признаком возможного дефицита клеточного иммунитета.
Т-хелперы._.
3. Соотношение =-= в норме |2 и больше| (Н.П.Шабалов,
Т-супрессоры 2000 г.)
4. КТТИ (кардио-тимо-торакальный индекс), который в норме ргеныпе 0,33,| высчитывается по показателям R-граммы грудной клетки в прямой проекции:
ab (мм)
КТТИ -
АВ(мм)
Трактовка полученного результата: увеличение КТТИ является показателем тимомегалии (вилочковой железы увеличенных размеров).
5. Отсутствие тени тимуса на рентгенограмме грудной клетки в боковой проекции трактуется как возможная гипофункция вилочковой железы.
Гуморальный иммунитет
В основе PftTfl TW1" НММУВгГРгТЯ ДРЖИ Т синтез а нтител.
Антитела (специфические иммуноглобулины) — это белки, относящиеся к к. синтезиро в анные клетками лим<ьоилной системы в отьет на появлен ие во внутренней среде организма антигенов. Они, выполняя главную биологическую функцию, вступают с антигенами в специфическую связь, которая называется образованием иммунного комплекса.
Внимание! Все антитела являются Ig, но не все Ig являются антителами.
Молекулы Ig состоят из соединенных между собой цепей:
- тяжелых Н-цепей (от англ. heavy) с большой молекулярной массой;
так как имеется 5 типов Н-цепей, иммуноглобулины разделены на
5 классов:
Пцепьу — IgG;
2) цепь a — Ig А;
3) цепь ц — Ig М:
4) цепь е — Ig Е;
5) цепь 6 — Ig D;
- легких L-цепей (от англ. light) с малой молекулярной массой; имеется 2 типа L-цепей, один из которых может быть в одной молекуле Ig:
1) тип ламбда — X;
2) тип каппа —к.
Обычно молекула Ig состоит из 2 тяжелых и 2 легких цепей и имеет формулу L-H-H-L.
Сила связи антитела с антигеном обозначается словом авидность (англ. avidity). Чем выше авидность, тем прочнее комплексы антиген-антитело. Наибольшей авидностью обладают антитела класса IgM.






