Понятие теплового равновесия является одним из главнейших исходных термодинамических понятий.
Опыт показывает, что если системы 1 и 2 находятся в тепловом равновесии с системой 3, то системы 1 и 2 будут также в тепловом равновесии друг с другом. Значение этого закона заключается в том, что он приводит к выводу о существовании температуры как характеристики теплового равновесия системы. Температура есть присущая каждому состоянию равновесия интенсивная величина. У всех систем, находящихся в тепловом равновесии друг с другом, температуры одинаковы. Наоборот, у систем, не находящихся между собой в тепловом равновесии, температуры различны.
Температура определяет направление перехода теплоты, то есть выступает как мера нагретости тела.
Закон теплового равновесия назвали нулевым началом термодинамики, поскольку он был предложен после третьего начала, хотя должен занимать в ряду этих основных законов первое место.
3. Первое начало термодинамики. Внутренняя энергия. Теплоёмкость.
Одно из важных понятий – внутренняя энергия системы U.
Внутренняя энергия тела – это полная энергия тела, за исключением кинетической энергии движения тела как целого (движения центра масс и вращения тела как целого) и потенциальную энергию тела во внешних полях.
В процессах важна не величина самой внутренней энергии, а её изменение в данном процессе.
Внутренняя энергия системы – это функция состояния, то есть однозначно определяется состоянием системы. Изменение внутренней энергии системы в каком-либо процессе не зависит от пути перехода, а только от начального и конечного состояния; а в замкнутом процессе, когда система возвращается в исходное состояние, изменение внутренней энергии равно нулю.
Внутреннюю энергию системы можно изменить за счёт:
1) совершения над системой работы;
2) сообщения системе теплоты.
(Считаем, что система не обменивается веществом с окружающей средой.)
По закону сохранения энергии
 (8.1)
(8.1)
Работа самой системы над внешними телами 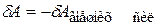 , тогда
, тогда
 (8.2)
(8.2)
Соотношения (8.1) и (8.2) – первое начало термодинамики:
Количество теплоты, сообщённое системе, идёт на приращение её внутренней энергии и на работу системы против внешних сил.
Теплота Q и работа A не являются функциями состояния системы, это – способы обмена энергией. Эти величины зависят от пути перехода, в отличие от изменения внутренней энергии; поэтому эти величины на бесконечно малом участке процесса не будут с точки зрения математики полными дифференциалами, и для них используются обозначения  и
и  .
.
4. Работа идеального газа при изменении объёма.
Рассмотрим идеальный газ в сосуде под поршнем площадью S. Давление газа равно p (рис.8.1).
При подъёме поршня на малую высоту dh сила давления газа
 (8.7)
(8.7)
совершит работу
 . (8.8)
. (8.8)
 ,
,
 , (8.9)
, (8.9)
так как  – увеличение объёма газа.
– увеличение объёма газа.
Работа газа при переходе между состояниями 1 и 2 работа равна
 |
 . (8.10)
. (8.10)
Работа равна площади под графиком  (рис.8.2).
(рис.8.2).






