Концентрацией раствора называется содержание растворенного вещества в определенной массе или объеме раствора или растворителя. Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными - концентрациями.
Концентрацию веществ в растворах можно выразить разными способами. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества ώ – это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m:
ώ = mв-ва / mр-ра . 100%
Массовую долю растворённого вещества ώ (B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Молярная концентрация Cм показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
Cм = nв-ва / V = mв-ва / Mв-ва · V,
где Мв-ва - молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2M NaOH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г MNaOH = 40 г/моль).
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Cн = mв-ва / Эв-ва · V,
где, Эв-ва – эквивалент растворенного вещества г
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Например:
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2· 3) = 342 / 2= 57 г
Пример 1. Вычислите: а) процентную (С%); б) молярную (С М); в) эквивалентную (С Н); г) моляльную (С m) концентрации раствора H 3 PO 4, полученного при растворении 18 г кислоты в 282 см 3 воды, если плотность его 1,031 г/см 3. Чему равен титр Т этого раствора?
Решение. а) массовая процентная концентрация показывает число граммов (единиц массы) раствора. Так как массу 282 см 3 воды можно принять равной 282 г, то масса полученного раствора 18 +282 = 300 г и, следовательно,
300 – 18
100 – С% С% = 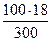 = 6%
= 6%
б) мольно-объемная концентрация или молярность, показывает число молей растворенного вещества, содержащихся в 1л раствора. Масса 1л раствора 1031г. Массу кислоты в литре раствора находим из соотношения
300 – 18
1031 – Х Х = 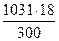 = 61,86
= 61,86
Молярность раствора получим делением числа граммов H 3 PO 4 в 1л раствора на мольную массу H 3 PO 4 (97,99 г/моль).
С М = 61,86 / 97,99 = 0,63 М
в) эквивалентная концентрация или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1л раствора. Так как эквивалентная масса
H 3 PO 4 = 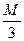 =
= 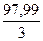 = 32,66 г/моль, то С Н = 61,86 / 32,66 = 1,89н;
= 32,66 г/моль, то С Н = 61,86 / 32,66 = 1,89н;
г) мольно-массовая концентрация или моляльность, показывает число молей растворенного вещества, содержащихся в 1000г растворителя. Массу H3PO4 в 1000г растворителя находим из соотношения
282 – 18
1000 – Х Х = 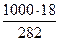 = 68,83
= 68,83
Отсюда С m = 68,83 / 97,99 = 0,65m
Титром раствора называется число граммов растворенного вещества в 1 см 3 (мл) раствора. Так как в 1л раствора содержится 61,86 кислоты, то
Т = 61,86 / 1000 = 0,06186 1г/см 3
Зная нормальность раствора и эквивалентную массу (m Э) растворенного вещества, титр легко найти по формуле
Т = СНmЭ / 1000.
Пример 2. На нейтрализацию 50 см 3 раствора кислоты израсходовано 25 см 3 0,5н раствора щелочи. Чему равна нормальность кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1/ V2 = СН2 / СН1 или V1СН1 = V2СН2
50 * С Н1 = 25 * 0,5, откуда С Н1 = 25 * 0,5 / 50 = 0,25н
Пример 3. К метиловому спирту массой 32г и плотностью 0,8 г/мл добавили воду до объема 80 мл. Определите объемную долю спирта в растворе.
Решение. Рассчитаем объем растворенного вещества:
V(спирт) = 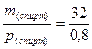 =40 мл
=40 мл
Определяем объемную долю спирта в растворе по соотношению
V(спирт) = 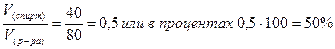 =40 мл
=40 мл
Пример 4. Найти массы воды и медного купороса CuSO 4 · 5Н 2 О, необходимые для приготовления одного литра раствора, содержащего 8% (масс) безводной соли. Плотность 8% раствора CuSO4 равна 1,084 г/мл.
Решение. Масса 1 л полученного раствора будет составлять 1,084 * 1000 = 1084г. В этом растворе должно содержаться 8% безводной соли, т.е. 1084 * 0,08 = 86,7г. Массу CuSO 4 * 5Н 2 О (мольная масса 249,7 г/моль), содержащую 86,7г безводной соли (мольная масса 159,6 г/моль), найдем из пропорции 249,7: 159,6 = Х: 86,7.
Х = 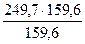 = 135,6
= 135,6
Необходимая для приготовления раствора масса воды составит 1084 – 135,6 = 948,4г.
Пример 5. К 1л 10% - ного раствора КОН (пл. 1,092 г/ см 3) прибавили 0,5л 5% - ного раствора КОН (пл. 1,045 г/ см 3). Объем смеси довели до 2л. Вычислить молярную концентрацию полученного раствора.
Решение. Масса 1л 10% - ного раствора КОН 1092 г. В этом растворе содержится 1092 * 10 / 100 = 109,2 г КОН. Масса 0,5л 5% - ного раствора 1045 * 0,5 = 522,5г. В этом растворе содержится 522,5 * 5 / 100 = 26,125г КОН.
В общем объеме полученного раствора (2л) содержимое КОН составляет 109,2 + 26,125 = 135,325г. Отсюда молярность этого раствора С М = 135,235 / 256,1 = 1,2М, где 56,1 г/моль – мольная масса КОН.
Пример 6. Какой объем 96% - й кислоты плотностью 1,8 г/см 3 потребуется для приготовления 3л 0,4 н раствора?
Решение. Эквивалентная масса
Н 2 SO 4 = 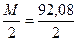 = 49,04 г/моль
= 49,04 г/моль
Для приготовления 3л 0,4 н раствора требуется 49,04 · 0,4 · 3 = 58,848 г Н 2 SO 4. Масса 1см 3 96% - ной кислоты 1,84 г. В этом растворе содержится 1,84 * 96 / 100 = 1,766 г Н 2 SO 4. Следовательно, для приготовления 3л 0,4 н раствора надо взять 58,848: 1,766 = 38,32 см 3 этой кислоты.
Закон эквивалентов: Все вещества реагируют между собой в эквивалентных количествах.
Иногда удобнее пользоваться другим определением закона эквивалентов: массы (объемы) реагирующих между собой веществ пропорциональны их молярным массам эквивалентов (объемам эквивалентов).
m1 / m2 = Э1 / Э2 – формула для веществ
Сн1 х V1 = Сн2 х V2 – формула для растворов
Титр – масса растворенного вещества в 1 мл раствора T = mв-ва / V
Пример 7. На нейтрализацию 31 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равна нормальность и титр раствора H2SO4?
Решение
Дано:
Vщ = 31 см3 по з-ну эквивалентов: Снщ * Vщ = Снк * Vк
Снщ = 0,16 н Снк = Снщ * Vщ / Vк, отсюда
Vк = 217 см3 Снк = 0,16н 31 см3 / 217 см3 = 0,02н
Снк =? Снк = mк / Эк * V; mк = Снк * Эк х V
титр -? Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г/моль
mк = 0,02 * 49 * 1л = 0,98 г
T = mк / V; Т = 0,098 / 1000 мл = 0,00098 г/мл
Ответ: Снк = 0,02 н; титр = 0,00098 г/мл
Температуры кристаллизации, замерзания и кипения растворов:
Раствор кипит при более высокой и замерзает при более низкой температуре, чем растворитель. Повышение температуры кипения и понижение температуры замерзания растворов прямо пропорционально их моляльной концентрации:
∆t0кип = ЕСm; ∆t0зам = КСm,
где
∆t0кип - повышение температуры кипения;
∆t0зам - понижение температуры замерзания;
Е - эбуллиоскопическая константа;
К - криоскопическая константа;
Сm - моляльная концентрация раствора.
Сm = 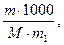
где m - масса растворенного вещества в 1000 г растворителя;
M - молекулярная масса растворенного вещества;
m 1 - масса растворителя.
Подставив С m в уравнение (I), получим:
∆t0кип = Е 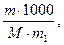 ∆t0зам = К
∆t0зам = К 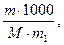
Зная t 0кип или t 0зам можно найти молекулярную массу растворенного вещества (М), эбуллиоскопическую (Е) или криоскопическую (К) константы.
Например. Определить температуру кипения 10% - го растворы глюкозы в воде. Е 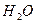 = 0,52 0.
= 0,52 0.
Решение. В 10% - ом растворе глюкозы в 100г раствора содержится 10г глюкозы и 90 г растворителя. Подставив конкретные значения:
Е 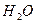 = 0,52 0, m = 10г; m 1 = 90г
= 0,52 0, m = 10г; m 1 = 90г
М 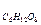 = 180 в уравнение (II), получим
= 180 в уравнение (II), получим
t 0кип = 0,52 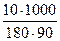 = 0,320 0
= 0,320 0
Вода кипит при р = 760 мм.рт.ст. при 100 0 С, поэтому температура кипения раствора равна 100 + 0,32 = 100,32 0 С.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
181. К 1 литру раствора с массовой долей HCl 20 % (ρ = 1,100 г/см3) добавили 400 см3 раствора с массовой долей HCl 5 % (ρ = 1,024 г/см3). Вычислите массовую долю HCl в полученном растворе. Ответ: 15,93%
182. Вычислить молярную концентрацию раствора сульфата калия,
20 мл которого содержат 1,74 г этой соли. Ответ: 0,5моль/л.
183. Сколько граммов оксида кальция содержится в 200 мл 0,3 н. раствора? Рассчитать титр раствора. Ответ: 37 г/моль; Т = 0,0111 г/мл.
184. Вычислить температуры кристаллизации, и кипения раствора с массовой долей сахара C12H22O11 = 5 %. Ответ: 0,060С; 100,060С
185. Рассчитайте, при какой температуре будет кристаллизоваться раствор, содержащий в 200 г бензола, 12 г нафталина? Ответ: 2,150С.
186. В каком количестве воды следует растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 °С? Ответ: 289 г
187. При растворении 6,9 г глицерина в 500 г воды температура замерзания понизилась на 0,279 °С. Определите молярную массу глицерина. Ответ: 92 г/моль
188. Вычислите: а) процентную (С %); б) молярную (СM); в) эквивалентную (Сн); г) моляльную (См) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр T этого раствора? Ответ: С% = 6%; б) СM = 0,63 М; в) Сн = 1,89 Н; г) См = 0,65 м; Т = 0,06186 г/см3.
189. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты? Ответ: 0,25Н
190. К 1 л 10%-ного раствора КОН (ρ = 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Ответ: 1,2 М
191. Какой объем 96%-ной кислоты (ρ = 1,84 г/см3) потребуется для приготовления 3 л 0,4 н раствора? Ответ: 33,32 см3
192. В какой массе воды надо растворить 44,8 л HCl (объем измерен при н. у.), чтобы получить 26 %-й раствор HCl? Ответ: 207,8 г
193. Какую массу воды надо прибавить к 3 моль К2SO4. 7H2O, чтобы получить 9 %-й раствор К2SO4? Ответ: 4900 г
194. Какой объем 0,3 М раствора Na3(PO4)2можно приготовить из 250 мл 1,5 н. раствора? Ответ: 417 мл
195. Плотность 12 %-го раствора Na2SO3равна 1,08 г/мл. Вычислить моляльность, молярность и эквивалентную концентрацию (нормальность) этого раствора. Ответ: Ст = 1,08 т; СМ = 1,03 М; СН = 2,06 Н
196. Сколько граммов поваренной соли и воды необходимо для приготовления 2 кг 20 % - го раствора? Ответ: 400 г соли; 1600 г воды
197. Сколько граммов КОН нужно взять для приготовления 500 мл 0,1М раствора? Ответ: 2,8 г
198. Сколько миллилитров 96 %-ной H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1 л 0,5 н. раствора? Ответ: 13,84 мл
199. Вычислить температуру замерзания раствора содержащего 54 г глюкозы С6Н12О6 в 250г воды. Криоскопическая константа воды равна 1,86 0С. Ответ: - 2,230С
200. К 1л 10%-ного раствора КОН (ρ = 1,092г/см3) прибавили 0,5л 5%-ного раствора КОН (ρ = 1,045г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Ответ: 1,2 М
201. Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце. Ответ: 24,8%
202. Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7; 34,8 и 40,5%. Ответ: KMnO4.
203. Сколько литров 6 н раствора NaOH следует добавить к 4,5 литрам 0,8 н раствора NaOH, чтобы смешанный раствор оказался двунормальным? Ответ: 1,35 л
204. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Чему равна процентная концентрация полученного раствора? Ответ: 45,57%
205. Вычислите молярную и эквивалентную концентрации 49% раствора H3PO4 плотностью 1,33 г/мл. Ответ: Cм = 0,6 М; Cн = 2 Н
206. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г
207. Сколько граммов 3% раствора MgSO4 можно приготовить, растворив в воде MgSO4 . 7H2O? Ответ: 16,3 г
208. Какой объем 10% раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 5 л 2% раствора (ρ = 1,02 г/мл)? Ответ: 0,9 л
209. К 3 л 10% раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2% раствора той же кислоты плотностью 1,009 г/мл. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л. Ответ: 5,082%; СМ = 0,83М
210. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г; ТNaOH = 0,016 г/мл






