1. Если окислитель и восстановитель – разные вещества, то такие реакции относят к межмолекулярным. Примерами таких процессов служат все рассмотренные ранее реакции.
2. При термическом разложении сложных соединений, в состав которых входят окислитель и восстановитель в виде атомов разных элементов, происходят окислительно-восстановительные реакции, называемые внутримолекулярными: (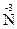 H4)2
H4)2 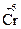 2O7
2O7 
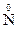 2 +
2 + 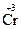 2O3 + 4H2O
2O3 + 4H2O
3. Реакции диспропорционирования могут происходить, если соединения, содержащие элементы в промежуточных степенях окисления, попадают в условия, где они оказываются неустойчивыми (например, при повышенной температуре). Степень окисления этого элемента и повышается и понижается: 2Н2 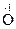 2
2 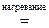
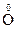 2 + 2Н2
2 + 2Н2 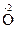
4. Реакции контрпропорционирования – это процессы взаимодействия окислителя и восстановителя, в состав которых входит один и тот же элемент в разных степенях окисления. В результате продуктом окисления и продуктом восстановления является вещество с промежуточной степенью окисления атомов данного элемента: Na2 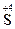 O3 + 2Na2
O3 + 2Na2 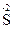 + 6HCl = 3
+ 6HCl = 3 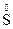 + 6NaCl + 3H2O
+ 6NaCl + 3H2O
5. Существуют также реакции смешанного типа. Например, к внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония: 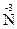 H4
H4 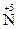 O3
O3 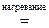
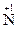 2O + 2H2O
2O + 2H2O
Составление уравнений. Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса. Метод электронно-ионных полуреакций применяют при составлении уравнений реакций, протекающих в водном растворе, а также реакций с участием веществ, в которых трудно определить степени окисления элементов (например, KNСS, CH3CH2OH). Согласно этому методу выделяют следующие главные этапы составления уравнения реакций:
1. Записывают общую молекулярную схему процесса с указанием восстановителя, окислителя и среды, в которой протекает реакция (кислотная, нейтральная или щелочная). Например:
SO2 + K2Cr2O7 + H2SO4(разб) ®...
2. Учитывая диссоциацию электролитов в водном растворе, данную схему представляют в виде молекулярно-ионного взаимодействия. Ионы, степени окисления атомов которых не изменяются, в схеме не указывают, за исключением ионов Н+ и ОН-:
SO2 + Cr2O72– + H+ ®...
3. Определяют степени окисления восстановителя и окислителя, а также продуктов их взаимодействия:
| Окисление восстановителя | Восстановление окислителя |
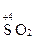 ® ® 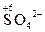
| 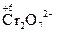 ® 2Cr3+ ® 2Cr3+
|
4. Записывают материальный баланс полуреакции окисления и восстановления:
| Окисление восстановителя | Восстановление окислителя |
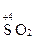 + 2H2O – 2 e = + 2H2O – 2 e = 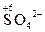 + 4H+ + 4H+
| 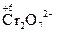 + 14H+ + 6 e = 2Cr3+ + 7H2O + 14H+ + 6 e = 2Cr3+ + 7H2O
|
5. Суммируют полуреакции, учитывая принцип равенства отданных и принятых электронов:
3∙ôSO2 + 2H2O – 2 e = 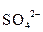 + 4H+
+ 4H+
1∙ô 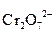 + 14H+ + 6 e = 2Cr3+ + 7H2О
+ 14H+ + 6 e = 2Cr3+ + 7H2О
3 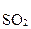 + 6H2O +
+ 6H2O + 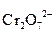 + 14H+ = 3
+ 14H+ = 3 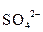 + 12H+ + 2Cr3+ + 7H2О
+ 12H+ + 2Cr3+ + 7H2О
и, сокращая одноименные частицы, получают общее ионно-молекулярное уравнение:
3 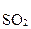 +
+ 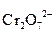 + 2H+ = 3
+ 2H+ = 3 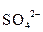 + 2Cr3+ + H2О.
+ 2Cr3+ + H2О.
6. Добавляют ионы, не участвовавшие в процессе окисления-восстановления, уравнивают их количества слева и справа, и записывают молекулярное уравнение реакции:
3SO2 + K2Cr2O7 + H2SO4 (разб) = Cr2(SO4)3 + K2SO4 + H2O.
При составлении материального баланса полуреакций окисления и восстановления, когда изменяется число атомов кислорода, входящих в состав частиц окислителя и восстановителя, следует учитывать, что в водных растворах связывание или присоединение кислорода происходит с участием молекул воды и ионов среды.
В процессе окисления на один атом кислорода, присоединяющийся к частице восстановителя, в кислотной и нейтральной средах расходуется одна молекула воды и образуются два иона Н+; в щелочной среде расходуются два гидроксид-иона ОН- и образуется одна молекула воды (табл.8.1).
Таблица 8.1. Присоединение атомов кислорода к восстановителю в процессе окисления
| Среда | Частицы, участвующие в присоединении одного атома кислорода | Образующиеся частицы | Примеры полуреакций окисления |
| Кислотная, нейтральная | Н2О | 2Н+ | SO32– + H2O – 2 e = SO42– + 2H+ SO2 + 2H2O – 2 e = SO42– + 4H+ |
| Щелочная | 2ОН- | Н2О | SO32– + 2OH- – 2 e = SO42– + H2O SO2 + 4OH- – 2 e = SO42– + 2H2O |
В процессе восстановления для связывания одного атома кислорода частицы окислителя в кислотной среде расходуются два иона Н+ и образуется одна молекула воды; в нейтральной и щелочной средах расходуется одна молекула Н2О и образуются два иона ОН- (табл.1.2).
Таблица 8.2. Связывание атомов кислорода окислителя в процессе восстановления
| Среда | Частицы, участвующие в связывании одного атома кислорода | Образующиеся частицы | Примеры полуреакций восстановления |
| Кислотная | 2Н+ | Н2О | 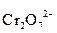 + 14H+ + 6e = 2Cr3+ + 7H2О
MnO4- + 8H+ +5 e = Mn2+ + 4H2O + 14H+ + 6e = 2Cr3+ + 7H2О
MnO4- + 8H+ +5 e = Mn2+ + 4H2O
|
| Нейтральная, щелочная | Н2О | 2ОН- | CrO42-+4H2O +3 e =[Cr(OH)6]3- + 2ОН- MnO4- +3H2O+3 e = MnO(OH)2 + 4OH- |
Метод электронного баланса обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах. Последовательность операций следующая:
1. Записывают формулы реагентов и продуктов реакции в молекулярном виде:
FeCl3 + H2S ® FeCl2 + S + HCl;
2. Определяют степени окисления атомов, меняющих ее в процессе реакции:
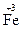 Cl3 + H2
Cl3 + H2 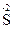 ®
® 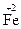 Cl2 +
Cl2 + 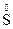 + HCl;
+ HCl;
3. По изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов: 2∙ ½ 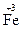 +1 e =
+1 e = 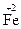
1∙ ½ 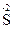 – 2 e =
– 2 e = 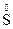
4. Множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты: 2FeCl3 + H2S ® 2FeCl2 + S + HCl
5. Подбирают стехиометрические коэффициенты остальных участников реакции: 2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
6. При составлении уравнений следует учитывать, что окислитель (или восстановитель) могут расходоваться не только в основной окислительно-восстановительной реакции, но и при связывании образующихся продуктов реакции, т.е. выступать в роли среды и солеобразователя. Примером, когда роль среды играет окислитель, служит реакция окисления металла в азотной кислоте, составленная методом электронно-ионных полуреакций:
Cu + HNO3(разб) ®...
Cu + NO3- + H+ ®...
3∙ ½ Cu – 2 e = Cu2+
2∙ ½ NO3- + 4H+ + 3 e = NO + 2H2O
3Cu + 2NO3- + 8H+ = 3Cu2+ + 2NO + 4H2O
3Cu + 2HNO3(окислитель) + 6HNO3(среда) = 3Cu(NO3)2 + 2NO + 4H2O
или 3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O.
Примером, когда восстановитель является средой, в которой протекает реакция, служит реакция окисления соляной кислоты дихроматом калия, составленная методом электронного баланса:
HCl + K2Cr2O7 ® CrCl3 + Cl2 + KCl + H2O
H 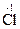 + K2
+ K2 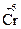 2O7 + HCl ®
2O7 + HCl ® 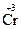 Cl3 +
Cl3 + 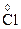 2 + KCl + H2O
2 + KCl + H2O
6∙ ½ 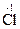 – 1 e =
– 1 e = 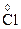
2∙ ½ 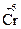 + 3 e =
+ 3 e = 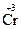
6 HCl(восстановитель) + K2Cr2O7 + HCl(среда) ® 2CrCl3 + 3Cl2 + KCl + H2O
6 HCl + K2Cr2O7 + 8HCl = 2CrCl3 + 3Cl2 +2 KCl + 7H2O
или 4HCl + K2Cr2O7 = 2CrCl3 + 3Cl2 +2 KCl + 7H2O
При расчете количественных, массовых и объемных соотношений участников окислительно-восстановительных реакций, используют основные стехиометрические законы химии, и, в частности, закон эквивалентов, учитывая, что число эквивалентности окислителя равно числу электронов, которые принимает одна формульная единица окислителя, а число эквивалентности восстановителя равно числу электронов, которые отдает одна формульная единица восстановителя.
Окисление-восстановление – это единый взаимосвязанный процесс. Атом элемента в своей высшей степени окисленности не может ее повысить (отдавать электроны) и проявляет только окислительные свойства, а в своей низшей степени окисленности не может ее понизить (принять электроны) и проявляет только восстановительные свойства. Атом же элемента, имеющий промежуточную степень окисленности, может проявлять как окислительные, так и восстановительные свойства.
Например:
N 5+ (HNO 3) проявляет только окислительные свойства;
N 4+ (NO 2) проявляет окислительные и восстановительные свойства;
N 3+ (HNO 2) проявляет окислительные и восстановительные свойства;
N 2+ (NO) проявляет окислительные и восстановительные свойства;
N 1+ (N 2 O) проявляет окислительные и восстановительные свойства;
N 0 (N 2) проявляет окислительные и восстановительные свойства;
N 1- (NH 2 OH) проявляет окислительные и восстановительные свойства;
N 2- (N 2 H 2) проявляет окислительные и восстановительные свойства;
N 3- (NH 3) проявляет только восстановительные свойства.
Пример 1. Исходя из степени окисленности (n) азота, серы и марганца в соединениях NH 3 HNO 2 HNO 3 H 2 S H 2 SO 3 H 2 SO 4 MnO 2 KMnO 4, определите какие из них могут быть только восстановителями, только окислителями, и какие проявляют как окислительные, так и восстановительные свойства.
Решение. Степень окисленности для азота в указанных соединениях соответственно равна: -3 (низшая), +3 (промежуточная), +5 (высшая); n для серы соответственно равна –2 (низшая), +4 (промежуточная), +6 (высшая); n для марганца соответственно равна +4 (промежуточная), +7 (высшая). Отсюда: NH 3, H 2 S – только восстановители; HNO 3, H 2 SO 4, KMnO 4 – только окислители; HNO 2, H 2 SO 3, MnO 2 – окислители и восстановители.
Пример 2. Составьте уравнение окислительно-восстановительной реакции идущей по схеме
+3 +7 +2 +5
H 3 PO 3 +KMnO 4 +H 2 SO 4 =MnSO 4 +H 3 PO 4 +K 2 SO 4 +H 2 O
Решение. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяет свою степень окисленности восстановитель и окислитель, и отражаем это в электронных уравнениях:
 восстановитель 5 P 3+ - 2e - = P 5+ - процесс окисления
восстановитель 5 P 3+ - 2e - = P 5+ - процесс окисления
окислитель 2 Mn 7+ + 5e - = Mn 2+ - процесс восстановления
Общее число электронов отданных восстановителем, должно быть равно числу электронов, которое присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя, а при делении 10 на 2 получаем коэффициент 5 для восстановителя. Коэффициент перед веществами, атомы которых не меняют свою степень окисленности, находят подбором. Уравнение реакции будет иметь вид:
5H 3 PO 3 +2KMnO 4 +3H 2 SO 4 =2MnSO 4 +5H 3 PO 4 +K 2 SO 4 +3H 2 O
Пример 3. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Решение. Цинк, как и любой металл, проявляет только восстановительные свойства.
В концентрированной серной кислоте окислительную функцию несет сера (+6). Максимальное восстановление серы означает, что приобретает минимальную степень окисленности. Минимальная степень окисленности серы как элемента VI группы равна –2. Цинк как металл II группы имеет постоянную степень окисленности +2. Поэтому электронные уравнения будут иметь вид:
 восстановитель 4 Zn 0 - 2e - = Zn 2+ - процесс окисления
восстановитель 4 Zn 0 - 2e - = Zn 2+ - процесс окисления
окислитель 1 S 6+ + 8e - = S 2- - процесс восстановления
Составляем уравнение реакции:
4Zn+5H 2 SO 4 =4ZnSO 4 +H 2 S+4H 2 O
Перед H 2 SO 4 стоит коэффициент 5, а не 1, так как четыре молекулы H 2 SO 4 идут на связывание четырех ионов Zn 2+.
Пример 5. Определите типы окислительно-восстановительных реакций для следующих процессов:
а) H 2 S+ HNO 3 = H 2 SO 4 + NO 2 + H 2 O
б) H 3 PO 3 = H 3 PO 4 + PH 3
в) (NH 4) 2 Cr 2 O 7 =N 2 + Cr 2 O 3 + H 2 O
Решение.
2- 5+ 6+ 4+
а) H 2 S+8HNO 3 = H 2 SO 4 +8NO 2 +4H 2 O

 восстановитель 1 S 2- - 8e - = S 6+ - процесс окисления
восстановитель 1 S 2- - 8e - = S 6+ - процесс окисления
окислитель 8 N 5+ +1e - = N 4+ - процесс восстановления
В этой реакции взаимодействуют два вещества, одно из которых служит восстановителем, а другое – окислителем. Такие реакции относятся к реакциям межмолекулярного окисления-восстановления.
3+ 5+ 3-
б) 4H 3 PO 3 =3H 3 PO 4 + PH 3

 восстановитель 3 P 3+ -2e - =P 5+ процесс окисления
восстановитель 3 P 3+ -2e - =P 5+ процесс окисления
 4{
4{
окислитель 1 P 3+ +6e - =P 3- процесс восстановления
В этой реакции исходное вещество проявляет функции как окислителя, так и восстановителя. Такие реакции являются реакциями самоокисления-самовосстановления (диспропорционирования).
3- 6+ 0 3+
в) (NH 4) 2 Cr 2 O 7 = N 2 + Cr 2 O 3 + H 2 O
 восстановитель 1 2N 3- - 6e - = 2N 0 - процесс окисления
восстановитель 1 2N 3- - 6e - = 2N 0 - процесс окисления
окислитель 1 2Cr 6+ + 6e - = 2Cr 3+ - процесс восстановления
В этой реакции и окислитель, и восстановитель входят в состав одного и того же вещества. Реакции такого типа называются реакциями внутримолекулярного окисления-восстановления.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
211. Какие из приведенных реакций являются окислительно-восстановительными? Укажите для каждой из них окислитель и восстановитель. а)Fe + 2HCl = FeCl2 + H2; б) FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl; в) Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3; г) 2KI + Cl2 = 2KCl + I2
212. Какой процесс окисления или восстановления происходит при следующих превращениях: 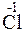
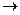
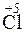 ;
; 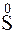
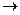
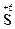 ;
; 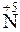
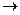
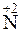 ;
; 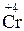
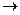
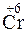 ;
; 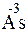
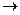
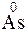 ;
; 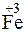
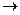
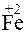 ?
?
213. Реакция выражается схемами: а) KClO3 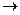 KClO4 + KCl; б) (NH4)2S + K2Cr2O7 + H2O
KClO4 + KCl; б) (NH4)2S + K2Cr2O7 + H2O 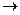 S + Cr(OH)3 + NH3 + KOH. Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
S + Cr(OH)3 + NH3 + KOH. Составьте электронные уравнения, расставьте коэффициенты, укажите окислитель и восстановитель.
214. Диоксид азота при растворении в воде образует смесь двух кислот. Напишите уравнение реакции и составьте уравнения электронного баланса.
215. Рассмотрите восстановительную способность щелочных металлов на примере взаимодействия лития с кислородом, водородом, хлором, серой, азотом, углеродом и водой.
216. Почему пероксид водорода может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений напишите реакции взаимодействия пероксида водорода с диоксидом свинца в азотнокислой среде, с сульфидом свинца в нейтральной среде.
217. Допишите уравнения реакций: а) Na2O2 + KI + H2SO4 ® …; б) Na2O2 + Fe(OH)2 + H2O ® …; в) Na2O2 + KMnO4 + H2SO4 ® …; г) Na2O2 + H2O ® …; д) Na2O2 + H2SO4 ®… Окислителем или восстановителем является пероксид натрия в этих реакциях?
218. Напишите реакции получения нитрида и гидроксида бария и разложения их водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
219. Почему хлор способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите реакцию растворения хлора в едком натре.
220. На основании электронных уравнений составьте уравнение реакции взаимодействия серы с азотной кислотой, учитывая, что сера окисляется максимально, а азот восстанавливается минимально.
221. Напишите формулы и назовите оксиды азота, укажите степени окисления азота в каждом из них. Какой из этих оксидов более сильный окислитель? На основании электронных уравнений закончите уравнение реакции, учитывая, что азот приобретает минимальную степень окисления: KNO2 + Al + KOH + H2O = KAlO2 + …
222. Какие степени окисления проявляет марганец в соединениях? Составьте формулы оксидов марганца, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов марганца при переходе от низшей к высшей степени окисления? Составьте уравнения реакций взаимодействия оксида марганца (II) с серной кислотой и оксида марганца(III) с гидроксидом калия.
223. Составьте электронные и молекулярные уравнения реакций растворения золота в царской водке и взаимодействия вольфрама с хлором. Золото окисляется до степени окисления (+3), а вольфрам - до максимальной.
224. Через подкисленный серной кислотой раствор дихромата калия пропустили газообразный сероводород. Через некоторое время оранжевая окраска перешла в зеленую и одновременно жидкость стала мутной. Составьте молекулярное и электронное уравнения происходящей реакции, учитывая минимальное окисление сероводорода.
225. Расставьте коэффициенты методом электронного баланса в следующем уравнении: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O.
226. Составить уравнение реакции сульфида мышьяка (III) As2S3 с концентрированной азотной кислотой по схеме: A2S2 + NO3– → AsO43– + SO42– + NO2 + H2O.
227. Сколько граммов FeSO4 можно окислить в присутствии H2SO4 с помощью 100 мл 0,25 н. раствора K2CrO4?
228. Соединения меди, серебра и золота хорошие окислители. Почему? Составьте электронные и молекулярные уравнения реакций: а) CuO + NH4Cl → N2 + …; б) Ag2O + Cr(OH)3 + NaOH → …; в) Au2O3 + H2O2 →…
229. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: KMnO4 + H2SO4 + Na2SO3 → MnSO4 + H2O + Na2SO4 + …
230. Подберите коэффициенты методом электронно-ионного баланса в уравнении окислительно-восстановительной реакции: Na2SO3 + KOH + KMnO4 → Na2SO4 + H2O + K2MnO4
231. Подберите коэффициенты в уравнении реакции, протекающей в нейтральной среде: KMnO4 + H2О + Na2SO3 → MnО2(т) + Na2SO4 + …
232. Подберите коэффициенты в уравнении реакции, протекающей в слабокислотной среде: KMnO4 + H2SO4 + Na2SO3 → MnО2(т) + H2O + Na2SO4 + …
233. Напишите уравнение реакции окисления дисульфида железа (II) концентрированной азотной кислотой. Составьте: схемы электронного и электронно-ионного баланса.
234. Напишите уравнения реакций, протекающих в водной среде: а) Na2SО3 + КМnО4 + Н2SО4 → X + …; б) Х + КОН →...
235. Могут ли проходить окислительно-восстановительные реакции между следующими веществами: а) H 2 S и HI; б) H 2 S и H 2 SO 3; в) H 2 SO 3 и HClO 4?
236. Определите типы окислительно-восстановительных реакций для следующих процессов: а) H 2 S+ HNO 3 = H 2 SO 4 + NO 2 + H 2 O; б) H 3 PO 3 = H 3 PO 4 + PH 3; в) (NH 4) 2 Cr 2 O 7 =N 2 + Cr 2 O 3 + H 2 O
237. Какие из указанных ниже соединений могут проявлять только окислительные свойства: CrSO4; K2CrO4; NaCrO2. Ответ обосновать.
238. Укажите, какие из приведенных процессов являются процессами окисления: а) SO2 → S2–; б) ClO– → Cl–; в) CrO2– → CrO42–
239. Укажите, какие из реакций являются окислительно-восстановительными: а) 2Al + Cr2O3 → Al2O3 + 2Cr; б) Al2(SO4)3 + 6 NaOH → 2Al(OH)3 + 3Na2SO4; в) Al(OH)3 + NaOH → Na[Al(OH)4]. Ответ обосновать.
240. Уравняйте методом электронного баланса уравнения окислительно-восстановительных реакций и укажите количество молекул окислителя: Na2MoO4 + HCl + Al → MoCl2 + AlCl3 + NaCl + H2O
РАЗДЕЛ 9. ГИДРОЛИЗ СОЛЕЙ.
Гидролиз солей –это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. При реакции гидролиза происходит разложение веществ водой приводящее к обменному взаимодействию ионов соли с молекулами воды, в результате которого изменяется характер среды (соотношение между ионами водорода и гидроксила в растворе).
Водородный показатель (рН): В воде всегда присутствует немного катионов водорода и гидроксидионов, которые образуются в результате обратимой диссоциации:
H2O 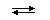 H+ + OH-
H+ + OH-
В 1 л чистой воды при комнатной температуре содержится 1 . 10-7 моль катионов водорода и 1 . 10-7 моль гидроксидионов. Поскольку оперировать числами такого порядка неудобно, для количественной характеристики кислотности среды используют так называемый водородный показатель рН. Каждое значение рН отвечает определенному содержанию катионов водорода 1л раствора. В чистой воде и в нейтральных растворах, где в 1 л содержится 1 .10-7моль катионов водорода, значение рН равно 7. В растворах кислот содержание катионов водорода увеличивается, а содержание гидроксидионов уменьшается, в растворах щелочей наблюдается обратная картина. В соответствии с этим меняется и значение водородного показателя (рН).
Кислоты, попадая в воду, диссоциируют, и содержание катионов водорода в расчете на 1 л раствора становится больше 1 .10-7 моль. Сильные кислоты в водной среде диссоциируют необратимо. Например, хлороводородная кислота полностью превращается в катионы водорода H+ и хлоридные анионы Cl-:
HCl = H+ + Cl-
Если в 1 л водного раствора содержится 1 .10-2 моль HCl, то катионов водорода H+ в этом объеме тоже 1 .10-2 моль. Значение водородного показателя (рН) для этого раствора оказывается равным 2. Когда в том же объеме раствора содержится 1 .10-3 моль HCl, то катионов H+ становится уже 1 .10-3 моль (рН = 3), если хлороводородной кислоты 1 .10-4 моль, то содержание H+ - 1 .10-4 моль (рН = 4), и т.д.
Диссоциация слабых кислот, например угольной, протекает обратимо:
H2CO3 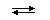 H+ + HCO3-
H+ + HCO3-
Далеко не все присутствующие в растворе молекулы H2CO3 превращаются в катионы H+ и анионы HCO3-. Тем не менее катионов H+ в растворах таких кислот больше, чем в чистой воде (например, 1 .10-5 или 1 .10-6 моль в каждом литре раствора). Таким образом, в растворах кислот катионов водорода в 1 л раствора содержится всегда больше, чем 1 .10-7, а рН оказывается меньше 7. Водородный показатель рН, меньший 7, отвечает кислотной среде раствора.
Если рН находится в интервале 5-7, то среда раствора считается слабокислотной, если рН меньше 5, то сильнокислотной: чем сильнее кислота, тем ниже значение рН.
В результате диссоциации оснований в водном растворе появляются гидроксидионы, которые связывают катионы водорода, присутствующие в чистой воде, и уменьшают их количество в щелочном растворе:
NaOH = Na+ + OH-
H+ + OH- = H2O
Растворение в 1 л воды 1 .10-2 моль сильного основания – гидроксида натрия NaOH приводит к появлению 1 .10-2 моль гидроксидионов. Содержание катионов водорода в полученном растворе оказывается равным 1 .10-12 моль, а рН принимает значение 12. Если в 1 л воды растворить 1 .10-3 моль NaOH, то гидроксидионов получится 1 .10-3 моль (1 .10-11 моль катионов H+, рН = 11).
Растворение в том же объеме 1 .10-4 моль NaOH даст 1 .10-4 моль OH- (1.10-10 моль катионов H+, рН = 10), и т.д. Таким образом, в растворах оснований содержание катионов водорода всегда меньше 1 .10-7 моль в 1 л, а водородный показатель (рН) - больше 7. Среда в таких растворах щелочная.
Для растворов сильных оснований, диссоциация которых идет необратимо, значение рН будет существенно выше 7. Диссоциация слабых оснований, например, гидрата аммиака, протекает лишь частично, гидроксидионов в этом случае образуется меньше, и рН не столь заметно превышает значение, характерное для нейтральной среды. Раствор считается слабощелочным при рН от 7 до 9 и сильнощелочным при рН выше 9.
Значения водородного показателя (рН) водных растворов распространенных веществ обычно находятся в интервале от 1 до 13. Приближенно оценить рН растворов можно с помощью кислотно-основных индикаторов. Для более точного измерения водородного показателя используют приборы рН-метры.
Реакция гидролиза – это реакция обратная реакции нейтрализации. При этом имеет место смещение равновесия диссоциации воды H 2 О ó OH - + Н + вследствие связывания одного из (или обоих) ионов воды ионами растворенного вещества с образованием малодиссоциированного или труднорастворимого продукта.
При составлении ионно-молекулярного уравнения реакции гидролиза необходимо:
а) записать уравнение диссоциации соли;
б) определить природу катиона и аниона;
в) записать ионно-молекулярное уравнение реакции, учитывая баланс электрических зарядов и что вода – слабый электролит (К = 1,8 * 10 -16).
Гидролиз протекает обратимо, ступенчато, продукты гидролиза солей, как правило, определяются первой ступенью. Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
1. Соли, образованные слабым основанием и сильной кислотой
2. Соли, образованные сильным основанием и слабой кислотой
3. Соли, образованные сильным основанием и сильной кислотой
4. Соли, образованные слабым основанием и слабой кислотой
Сильные основания образовывают щелочные металлы – это металлы 1 группы, главной подгруппы и щелочно-земельные металлы – это металлы 2 группы, главной подгруппы, начиная с Ca.
Сильные кислоты – это кислоты, которые практически полностью диссоциируют при попадании в воду. Сильные бескислородные кислоты образуют только галогены (за исключением F (фтора)). Это HCl, HBr, HI. Сильные кислородосодержащие кислоты – это HNO3, HMnO4, H2SO4, H2CrO4
1. Соли, образованные слабым основанием и сильной кислотой (Bi(NO3)3, FeCl2, NH4Cl, Al2(SO4)3, MgSO4 и т.д.) подвергаются ступенчатому гидролизу, при котором накапливаются катионы H+.
Bi(NO3)3 + 3HOH ó Bi(OH)3 + 3HNO3
Гидролиз этой соли протекает по катиону, запишем сокращенное ионное уравнение гидролиза, помня, что гидролиз протекает обратимо (равновесие смещено в сторону обратной реакции) и ступенчато (к исходному иону присоединяется только один гидроксильный ион):
1 ст. Bi(NO3)3 + HOH ó [BiOH](NO3)2 + HNO3
Bi3+ + 3NO3- + HOH ó BiOH2+ + 2NO3- + Н+ + NO3-
Bi3+ + HOH ó BiOH2+ + Н+
На первой ступени образуется основная соль – нитрат гидроксовисмута
2 ст. [BiOH](NO3)2 + HOH ó[Bi(OH)]2NO3 + HNO3
BiOH2+ + 2NO3- + HOH óBi(OH)2+ + NO3- + H+ + NO3-
BiOH2+ + HOH óBi(OH)2+ + H+
На второй ступени образуется основная соль – нитрат дигидроксовисмута
3 ст. [Bi(OH)]2NO3 + HОН ó Bi(OH)3 + HNO3
2BiOH2+ + NO3- + HOH ó Bi(OH)3 + H+ + NO3-
2BiOH2+ + HOH ó Bi(OH)3 + H+
В результате гидролиза образуется гидроксид висмута слабый электролит, катион H+. Раствор приобретает кислую среду, рН раствора < 7
В холодных и умеренно концентрированных растворах солей гидролиз протекает по первой ступени. При повышении температуры и разбавлении растворов гидролиз усиливается, равновесие смещается в сторону прямой реакции, и тогда могут протекать и вторые ступени гидролиза.
2. Соли, образованные сильным основанием и слабой кислотой (К2S, Na2SiO3, Na2CO3 и т.д.) подвергаются ступенчатому гидролизу, при котором накапливаются гидроксидионы ОН-.
K2S + 2НОH ó H2S + 2KОН
Гидролиз протекает за счет взаимодействия ионов S- с молекулами H2O. Запишем сокращенное ионное уравнение реакции гидролиза, помня, что гидролиз протекает обратимо (при этом равновесие смещено в сторону обратной реакции) и ступенчато (к исходному иону присоединяется только один ион водорода):
1 ст. K2S + НОH ó KHS + KОН
2K+ +S2- + НОH ó НS- + 2K+ + ОН-
S2- + НОH ó НS- + ОН-
2 ст. KHS + НОН ó H2S + KОН
K+ +НS- + НОH ó Н2S- + K+ + ОН-
НS- + НОH ó Н2S- + ОН-
В результате гидролиза образуется слабый электролит гидроксидион ОН-, и другие ионы. Раствор приобретает щелочную среду, рН раствора > 7
3. Соли, образованные сильным основанием и сильной кислотой (KBr, NaCl, NaNO3 и т.д.), не гидролизуются, т.е. не взаимодействуют с ионами воды.
NaCl + HOH ó NaOH + HCl
Na+ + Cl- + HOH ó Na + + OH- + H+ + Cl-
HOH ó OH- + H+
В этом случае слабый электролит не образуется. Реакция среды остается нейтральной, рН раствора = 7
4.Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3, Al2S3). Соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются одновременно и по катиону, и по аниону с образованием слабого основания и слабой кислоты. Характер среды в таких растворах будет зависеть от свойств образующихся слабых электролитов.
СН3СООNН4 + НОH ó СН3СООН + NН4ОH
СН3СОО- + NН4+ + НОH ó СН3СООН + NН4 + + ОH-
В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания, т.е. реакция среды может быть либо слабокислой (если основание образовавшееся в результате гидролиза окажется более слабым, чем кислота), либо слабощелочной (если основание образовавшееся в результате гидролиза окажется более сильным, чем кислота), либо нейтральной (если образующееся кислота и основание имеют одинаковую силу). Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Таблица 9.1.
Константы диссоциации Kа(b) некоторых слабых электролитов при 298 К
| Электролит | Уравнение диссоциации | K а(b) |
| Азотистая кислота | HNO2 D NO2– + Н+ | 5,1×10–4 |
| Бензойная кислота | НС7Н5О2 D С7Н5О2– +Н+ | 6,14×10–5 |
| Бромноватистая кислота | HBrO D BrO– + Н+ | 2,1×10–9 |
| Муравьиная кислота | НСООН D НСОО- + Н+ | 1,8×10–4 |
| Фтороводородная кислота | HF D F- + H+ | 7,4×10–4 |
| Сернистая кислота | H2SO3 D HSO3- + H+ HSO3– D SO32- + H+ | 1,3×10–2 5,0×10–6 |
| Сероводородная кислота | H2S D HS- + H+ HS– D S2- + H+ | 5,7×10–8 1,2×10–13 |
| Угольная кислота | Н2СО3 D НСО3- + Н+ НСО3– D СО32- + Н+ | 4,3×10–7 5,6×10–11 |
| Уксусная кислота | СН3СООН D СН3СОО- + Н+ | 1,8×10–5 |
| Фосфорная кислота | H3PO4 D H2PO4- + H+ H2PO4– D HPO42- + H+ HPO42– D PO43- + H+ | 7,5×10–3 6,2×10–8 2,2×10–13 |
| Цианистоводородная кислота | HCN D CN– + H+ | 4,9×10–10 |
| Щавелевая кислота | Н2С2О4 D НС2О4- +Н+ НС2О4– D С2О42- +Н+ | 5,9×10–2 6,4×10–4 |
| Гидроксид аммония | NH4OH D NH4+ + OH- | 1,77×10–5 |
| Гидроксид свинца | Pb(OH)2 D PbOH+ + OH- PbOH+ D Pb2+ + OH- | 9,6×10–4 3,0×10–8 |
| Гидроксид цинка | Zn(OH)2 D ZnOH+ + OH- ZnOH+ D Zn2+ + OH- | 5,0×10–5 1,5×10–9 |
Для того чтобы определить характер среды, необходимо сопоставить константы диссоциации слабой кислоты СН3СООН (Кд = 1,8×10–5) и слабого основания NН4ОH (Кд = 1,77×10–5). Из сравнения констант диссоциации кислоты и основания [1,8×10–5 ≈ 1,77×10–5] следует, что раствор должен иметь нейтральную среду.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
241. Какое значение рН имеют растворы солей К 2 S, CrCl 3? Составьте ионно-молекулярное и молекулярное уравнения гидролиза этих солей.
242. см. условие задачи 241: ZnCl 2 и Na 2 CO 3
243. см. условие задачи 241: CH 3 COONH 4 и KCN
244. см. условие задачи 241: FeCl 3 и Na 2 CO 3
245. см. условие задачи 241: NH 4 CN и KCl
246. см. условие задачи 241: Cu(NO 3) 2 и Na 2 CO 3
247. см. условие задачи 241: AlCl 3 и CaS
248. см. условие задачи 241: NiSO 4 и K 2 S
249. см. условие задачи 241: Pb(NO 3) 2 и Fe 2 (SO 4) 3
250. см. условие задачи 241: AlCl 3 и RbCN
251. см. условие задачи 241: Al(NO 3) 3 и CH 3 COONH 4
252. см. условие задачи 241: CuCl 2 и Cs 2 S
253. см. условие задачи 241: Cr(NO 3) 3 и Na 2 SO 3
254. см. условие задачи 241: Al 2 (SO 4) 3 и Са(CH 3 COO) 2
255. см. условие задачи 241: FeCl 2 и Ni(NO 3) 2
256. см. условие задачи 241: Fe(NO 3) 3 и Na 2 SiO 3
257. см. условие задачи 241: MgSO 4 и Na 2 SiO 3
258. см. условие задачи 241: Cr(NO 3) 3 и K 2 S
259. см. условие задачи 241: Al 2 S 3 и NaF
260. см. условие задачи 241: NiSO 4 и NaCN
261. см. условие задачи 241: K 3 PO 4 и Ba(ClO) 2
262. см. условие задачи 241: CuSO 4 и K 2 CO 3
263. см. условие задачи 241: Zn(NO 3) 2 и NH 4 CNS
264. см. условие задачи 241: AlBr 3 и K 2 S
265. см. условие задачи 241: SbCl 3 и NaH 2 PO 4
266. см. условие задачи 241: AlI 3 и Na 3 BO 3
267. см. условие задачи 241: CH 3 COONH 4 и KClO
268. см. условие задачи 241: Cr 2 (SO 4) 3 и Ca(CH 3 COO)2
269. см. условие задачи 241: K 2 CO 3 и NiCl 2
270. см. условие задачи 241: BaCl 2 и Rb 2 S






