В химии широко используется два основных метода исследования термодинамический кинетической. Если очень кратко попытаться охарактеризовать различие между ними, то суть его в том, что главным вопросом в термодинамике является: «Почему происходит химическая реакция, что является их движущей силой?», а в кинетеке – «Как проходит химическая реакция?» Поэтому при термодинамическом анализе важно не время, а принципиальная возможность осуществления той или иной реакции, тогда, как кинетический анализ непосредственно связан со временем и скоростью процесса. Как известно, причиной протекания химических реакцией, их движущей силой является стремление любой материальной системы к выигрышу (уменьшению) энергии. Для изобарноизотермических процессов это стремление выражается уменьшением энергии Гиббса. Таким образом, кинетические исследования проводятся только для термодинамически возможных реакций. При этом задачей химической кинетики является изучение закономерностей протекания реакции во времени, ее скорости и механизма. Получение этих данных представляет большое практическое значение, поскольку открывает возможность сознательного управления промышленными процессами, позволяют решать вопросы интенсификации технологических процессов и другие задачи.
Химическая реакция состоит в превращении одного или нескольких химических веществ называемых исходными веществами (или реагентами) в одно или несколько других химических веществ называемых продуктами реакции. Часть это превращение состоит из нескольких стадий, называемых элементарными актами. Совокупность стадий, из которых складывается химическая реакция, называется механизмом химической реакции. По числу частиц или молекул, участвующих в элементарном акте реакции, судят о ее молекулярности. С этой точки зрения различают моно- би- и тримолекулярные реакции.
Первые встречаются часть, вторые крайне редко. Например, реакция
 2A+B A2B может протекать по двум механизмам: простому и сложному. В первом случае реакция тримолекулярна и осуществляется в одну стадию. Во втором случае реакция протекает в две последовательные бимолекулярные стадии:
2A+B A2B может протекать по двум механизмам: простому и сложному. В первом случае реакция тримолекулярна и осуществляется в одну стадию. Во втором случае реакция протекает в две последовательные бимолекулярные стадии:
I.  A+B AB
A+B AB
II.  AB+A A2B
AB+A A2B
Частица типа AB, называются промежуточными частицами, если они неустойчивы, и промежуточными веществами, если они устойчивы, и способны существовать в виде индивидуальных химических соединений. Установление детального механизма химической реакции является очень сложной задачей и основано в первую очередь, на изучении скорости реакции. При рассмотрении вопроса о скорости реакции необходимо различать гомогенные и гетерогенные реакции: Гомогенные реакции протекают в однородной среде, например взаимодействие в жидких растворах. Гетерогенные реакции протекают в неоднородной среде (между веществами которые находятся в разных фазах), следовательно, на границе раздела фаз, например, коррозия металлов. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скоростью гетерогенной реакции называют количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы. Оба эти определения можно записать в математической форме. Введем обозначения: Ѵгомог – скорость гетерогенной реакции; n – число молей какого-либо из получающихся при реакции веществ; V – объем системы; t – время; S – площадь поверхности фазы; на которой протекает реакция, ∆ - знак приращения (∆n=n2-n1; ∆t=t2-t1), тогда,
Ѵгомог=∆n/(V*∆t); Ѵгетерог=∆n/S∆t
Первое из этих уравнений можно упростить. Отношение количества вещества (n) к объему (V) системы представляет собою молярную концентрацию (C) данного вещества: n/V=C, откуда ∆n/V=∆C и следовательно: Ѵгомог=∆C/∆t. Последнее уравнение является математическим выражением другого определения скорости реакции в гомогенной системе: скоростью реакции в гомогенной системе называется изменение концентрации какого либо из веществ, вступающих в реакцию или образующихся при реакции, происходящее за единицу времени. К важнейшим факторам влияющим на скорость реакции относятся следующие: природа реагирующих веществ, их концентрация, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит так же от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция 1) Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации известна давно и подтверждается большими числом экспериментальных данных. Еще М.В. Ломоносов указывает, что реагируют только сталкивающиеся молекулы. Поэтому число столкновений молекул реагирующих веществ пропорционально их концентрации, т.е. чем выше концентрация, тем выше вероятность столкновений, а следовательно и скорость реакции. Для большинства химических реакций эта зависимость составляет суть основного закона кинетики: скорость реакции в каждой момент времени пропорциональна произведению концентрации взаимодействующих веществ, возведенных в некоторую степень. Математическое выражение этого закона: Ѵ=[A1]n: [A2]n2 …. [AL]nL
Для реакций: A+B=C Ѵ=k[A] * [B]
2A+B=A2B Ѵ=k[A]2 * [B]
Коэффициент k – называют константой скорости реакции. k – зависит от природы реагирующих веществ, от температуры, от присутствия катализатора, но не зависит от концентрации веществ. 2) зависимость скорости реакции от температуры реагирующих веществ. Скорость химической реакции чувствительна к изменению температуры. В кинетическом уравнении это учитывается константой скорости, имеющей различные значения при различных температурах. В чем же причина зависимости скорости реакции от температуры. Впервые количественная зависимость скорости реакции от температуры была установлена Вант – Гоффом: при повышении температуры на каждые 100С скорость реакции увеличивается в 2,4 раза. Ѵ2=Ѵ1 * α(T2-T1)/10 где Ѵ1 – скорость реакции при температуре T1; Ѵ2 – скорость реакции при температуре T2; α – температурный коэффициент реакции. В дальнейшем теорию зависимости скорости реакции от температуры развил Аррениус. Он выдвинул гипотезу согласно которой в эффективном столкновении (столкновении, приводящем к образованию новых молекул) принимают участие лишь активные молекулы, т.е. частицы энергетический запас которых превышает некоторую минимальную величину, характерную для данной реакции. Эта величина получила название энергии активации реакции Ea. Или другими словами для того чтобы исходные молекулы превратились в молекулы продуктов реакции, через образование какого-либо неустойчивого промежуточного соединения, необходимо затратить энергию.
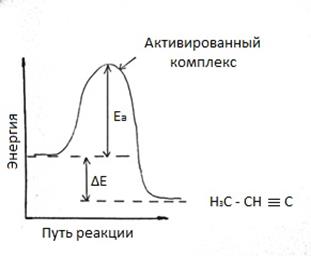
Рисунок 1 – Энергетическая схема хода реакции
Экзотермический процесс. Продукт имеет более низкую энергию, чем реагент. При любой температуре лишь небольшая часть столкновений происходит с энергией, достаточной для преодоления барьера реакции. Однако, при повышении температуры распределение молекул газа по скоростям смещается в сторону более высоких значений. Такими же свойствами обладает распределение молекул по кинетической энергии. При повышении температуры увеличивается доля осуществления реакции. Итак при повышении температуры возрастает не только общее число столкновений, но и доля столкновений с энергией, достаточной для осуществления реакции. 3) Влияние катализатора на скорость химической реакции, но само не подвергается окончательному химическому превращению в результате данного процесса. Почти все катализаторы повышают скорость реакций. Явление изменения таких веществ называется катализом. Реакции, протекающие под действием катализаторов, называют каталитическими. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов возникающих без катализатора. Таким образом, энергия активации реакции понижает, некоторые молекулы энергии которых была недостаточна для активных столкновений, теперь оказываются активными. Механизм действия катализатора можно представить следующей схемой.
1. A+K= AK (активированный комплекс)
2.  AK+B AB+K
AK+B AB+K
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор) В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Химическое равновесие.
Все химические реакции можно разбить на две группы: необратимые и обратимые. Реакции, которые протекают только в одном направлении и завершают полным превращением исходных реагирующих веществ в конечные вещества называются необратимыми. Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:

2KClO3 = 2KCl + 3O2
Реакция прекратиться тогда, когда весь KClO3 превратиться в KCl и O2. Необратимых реакций не так много. Большинство реакций являются обратимыми. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
3H2 + N2 = 2NH3 ∆H= -46,2 кДж/моль
В технике обратимые реакции, как правило не выгодны. Поэтому различными методами (изменение температуры, давления и др.) их делают практически необратимыми: Признаки необратимости реакции: 1) образующиеся вещества уходят из сферы реакции – выпадают в виде осадка, выделяются в виде газа, например:
 BaCl2 + H2SO4 = BaSO4 + 2HCl
BaCl2 + H2SO4 = BaSO4 + 2HCl
 Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
2) образуется малодиссоциированное соединение, например вода:
HCl + NaOH= NaCl + H2O
3) Реакция сопровождается большим выделением энергии, например горение магния: 2Mg + O2 = 2MgO, ∆H= - 602,5 кДж/моль
В уравнениях необратимых реакций между левой и правой частями ставится знак равенства или стрелка. Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Например, в реакции синтеза аммиака равновесие наступает тогда, когда в единицу времени образуется столько же молекул аммиака, сколько их распадается на азот и водород. Следовательно, химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой. В состоянии равновесия прямая и обратная реакции не прекращаются. Поэтому такое равновесие называется подвижным или динамическим равновесием. Поскольку действие обеих реакций взаимно уничтожается, то в реагирующей смеси видимых изменений не происходит: концентрации всех реагирующих веществ – как исходных, так и образующихся – остаются строго постоянными. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Они обычно обозначаются формулами реагирующих веществ, заключенными в квадратные скобки, например [H2], [N2], [NH3]. Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода:
H2 + 2 = 2HI
Согласно закону действия масс скорости прямой (Ѵ1) и обратной (Ѵ2) реакций выражают уравнениями:
Ѵ1 = K1[H2] [I2]; Ѵ2 = K2[HI]2
При равновесии скорости прямой и обратной реакций равны, откуда
K1[H2] [I2] =K2[HI]2 или K1/K2 = [HI]2/[H2] [I2]
Отношение констант скорости прямой и обратной реакции тоже представляет собой константу. Она называется константой равновесия данной реакции
(K): K1/K2 = K
Отсюда следует:
K=[HI]2/[H2] [I2]
При постоянной температуре (K) обратимой реакция представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ, в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия. В случае гетерогенных реакций, например для реакции
CO2+C=2CO
K имеет вид K=[CO]2/[CO2], как видим входят концентрации только тех веществ, которые находятся только в газовой фазе (возможно в жидкой фазе.
Величина (K) зависит от природы реагирующих веществ и от T. От присутствия катализатора не зависит. Поскольку катализатор энергию активации и прямой, и обратной реакции на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния. На состояние химического равновесия оказывает влияние концентрация реагирующих веществ, T, а для газообразных веществ и давление. При изменении одного из этих параметров равновесие нарушается и концентрация всех реагирующих веществ изменяет до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций. Подобный переход реакционной системы от одного состояния равновесия к другому называется смещением (или сдвигом) химического равновесия. Направление смещение химического равновесия при изменениях концентрации реагирующих веществ, T и P (в случае газовых реакций) определяется общим положением, известным под названием принципы подвижного равновесия или принципа Ле Шателье: Если на систему, находящуюся в состоянии равновесия, производится какое-либо внешнее воздействие (изменится концентрация, T, P), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
1) Влияние изменения концентрации какого-либо из веществ на смещении равновесия. Рассмотрим реакцию H2 + I2 = 2HI Пусть пары I2, H2 и HI находятся в равновесии друг с другом при определенных T и P. Введем в систему дополнительно некоторое количество H2. Увеличение концентрации количества H2 благоприятствует реакции, вызывающей уменьшение концентрации этого вещества, и, следовательно равновесие сместится в сторону образования йодоводорода или вправо. Тоже самое наблюдаем при увеличении концентрации I2. Соответственно увеличение концентрации HI смещает равновесии в сторону исходных веществ или влево. Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого – либо из веществ равновесие смещается в сторону образования этого вещества
2) Влияние T на смещение химического равновесия. Рассмотрим синтез аммиака
N2+3H2=2NH3 ∆H= -46,2 кДж/моль
Эта реакция экзотермическая. Поскольку прямая реакция, как видно из уравнения, протекает с выделением теплоты, повышения T смеси благоприятствует протеканию реакции с поглощением теплоты, и равновесия сместится в сторону исходных веществ, т.е. влево. Понижение T вызовет смещение равновесия в сторону продукта реакции, т.е. вправо. Синтез оксида азота (II) N2+O2=2NO ∆H=+….., представляет собой эндотермическую реакцию. Поэтому при повышении T равновесие сместится вправо в сторону образования NO. При понижении T – влево.
3) Влияние давления на смещение равновесия.
Чтобы определить влияние давления на смещение равновесия необходимо подсчитать число молекул в левой и правой частях уравнения. В уравнении для синтеза аммиака:
N2+BH2 = 2NH3 в левой части уравнения содержится четыре молекулы, а в правой две. Поскольку увеличение давления должно благоприятствовать процессу ведущему к уменьшению числа молекул, то в данном случае равновесие сместится в сторону исходных веществ. Если же в уравнении обратимой реакции число молекул в левой части равно числу молекул в правой части, например N2+O2 = 2NO, то изменение давления не вызывает смещения химического равновесия. Способы смещения равновесия в желательном направлении, основанные на принципе Ле Шателье, играют огромную роль в химии. Синтез аммиака многие другие промышленные процессы были освоены благодаря применению способов смещения равновесия в направлении, обеспечивающем высокий выход получаемого вещества.
Пример 1. Во сколько раз измениться скорость прямой и обратной реакции в системе 2SO2 (г)+ О2 (г) ↔ 2SO3 (г), если объём газовой смеси уменьшить в три раз? В какую сторону измениться равновесие системы?
Решение. Обозначим концентрации реагирующих веществ [SO2]=a, [O2]=b, [SO3]=c. Согласно закону действия масс скорости прямой и обратной реакции до изменения объёма
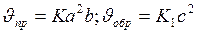
После уменьшения объёма гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2]=3a, [O2]=3b, [SO3]=3c. При новых концентрациях скорости (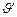 ) прямой и обратной реакции:
) прямой и обратной реакции:
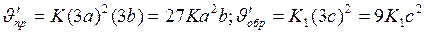
Отсюда
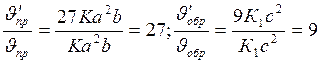
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной - только в девять раз. Равновесие системы сменилось в сторону образования SO3.
Пример 2. В системе А (г.) + 2В (г.) = С (г.) равновесные концентрации равны:  Найти константу равновесия реакции и исходные концентрации вещества А и В.
Найти константу равновесия реакции и исходные концентрации вещества А и В.
Решение. Константа равновесия данной реакции выражается уравнением:
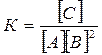 .
.
Подставляя в него данные задачи, получаем:
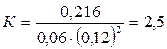

Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, 1 моля А и 2 молей В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моля вещества С, то при этом было израсходовано 0,216 моля А и 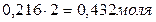 В. Таким образом, искомые исходные концентрации равны:
В. Таким образом, искомые исходные концентрации равны:

Пример 3. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле

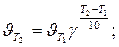

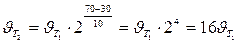
Следовательно, скорость реакции (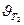 ) при температуре 70оС больше скорости реакции (
) при температуре 70оС больше скорости реакции ( ) при температуре 30оС в 16 раз.
) при температуре 30оС в 16 раз.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
151. Как изменится скорость реакции образования аммиака N2 + 3H2 D 2NH3, если а) увеличить давление в системе в два раза и б) увеличить объем газовой смеси в три раза? Ответ: а) в 16 раз; б) в 81 раз
152. Вычислите температурный коэффициент скорости реакции, зная, что с повышением температуры на 60 °С скорость возрастает в 128 раз. Ответ: 6
153. Окисление аммиака идет по уравнению 4NH3 + 5O2 D 4NO + 6H2O. Через некоторое время концентрации веществ были равны следующим значения (моль/л): [NH3]t = 0,009; [O2]t = 0,002; [NO]t = 0,003. Вычислите концентрацию водяного пара в этот момент и исходные концентрации аммиака и кислорода. Ответ: D[H2O] = 0,0045 моль/л; [NH3]исх. = 0,012 моль/; [O2]исх. = 0,0238 моль/л.
154. Равновесие системы 2SO2 + O2 D 2SO3 установилось, когда концентрации компонентов (моль/л) были: [SO2]равн. = 0,6; [O2]равн. = 0,24; [SO3]равн. = 0,21. Вычислите константу равновесия этой реакции и исходные концентрации кислорода и диоксида серы. Ответ: К= 0,51; [SO2]исх = 0,81 моль/л; [O2]исх. = [O2]равн. + [O2]изр. = 0,24 + 0,105 = 0,345 моль/л.
155. В каком направлении сместится равновесие в реакциях при повышении температуры, понижении давления и увеличении концентрации водорода? а) CO(г) + H2O(г) D CO2(г) + H2(г), DH0 = -41,84 кДж; N2(г) + 3H2(г) D 2NH3(г), DH0 = 92,40 кДж; H2(г) + S(тв) D H2S(г), DH0 = -20,50 кДж
156. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г)  2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Ответ: прямой увеличилась в 27 раз, обратной в 9 раз.
2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Ответ: прямой увеличилась в 27 раз, обратной в 9 раз.
157. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2. Ответ: в 16 раз.
158. Константа равновесия гомогенной системы: СО(г) + Н2О(г)  СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Ответ: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 1,8 моль/л; [Н2О]р =0,8 моль/л.
СО2(г) + Н2(г) при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л. Ответ: [СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л; [СО]р = 1,8 моль/л; [Н2О]р =0,8 моль/л.
159. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: PCl5(г)  РСl3(г) + Сl(г); D Н = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
РСl3(г) + Сl(г); D Н = + 92,59 кДж. Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции – разложения PCl5?
160. Как изменится скорость реакции 2NO(г) + O2(г)= 2NO2(г), если общее давление в системе уменьшить в 5 раз? Ответ: Увеличилась в 125 раз
161. В какую сторону сместится равновесие в реакции: CO2 (г) + C (тв) = 2 CO (г); D H ° > 0 а) при повышении температуры; б) при увеличении давления? Напишите выражение для константы равновесия.
162. Реакция в газовой фазе протекает по уравнению: А + В «2С. Определить равновесные концентрации реагирующих веществ, если исходные концентрации (моль/л): [А] = 4; [В] = 6; константа равновесия К = 1. Ответ: [А] = 2,1 моль/л; [В] = 4,1 моль/л; [С] = 3,8 моль/л.
163. Константа скорости реакции при 283 К равна 1,08. 10–4, а при 333 К равна 5,484. 10–2. Вычислить энергию активации и константу скорости реакции при 303 К. Ответ: ЕА = 97600 кДж/моль; К303 = 1,67 * 10-3
164. Написать выражения закона действия масс для реакций: а) 2NO(г) + Cl2(г) = 2NOCl(г); б) СаСО3(к) = СаО(к) + СО2(г). Как изменится скорость реакции 2NO(г) + О2(г) = 2NO2(г), если уменьшить объем реакционной смеси в три раза? Ответ: возрастет в 27 раз.
165. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастает скорость реакции при повышении температуры от 20 до 75 0С? Ответ: увеличится в 287 раз.
166. В системе А(г) + 2В(г) = С(г) равновесные концентрации равны: [А] = 0,06 моль/л, [В] = 0,12 моль/л, [С] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В. Ответ: К = 2,5; [А0] = 0,276 моль/л; [В0] = 0,552 моль/л.
167. Как изменится скорость реакции 2NO(г.)+O2(г.)→2NO2(г.) если уменьшить объём реакционного сосуда в 3 раза? Ответ: возросла в 27 раз.
168. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастёт скорость реакции при повышении температуры от 20 до 75 0С? Ответ: в 287 раз.
169. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, а с катализатором – 50,14 кДж/моль. Во сколько раз возрастёт скорость реакции в присутствии катализатора, если реакция протекает при 298 К. Ответ: возросла в 25 тысяч раз.
170. При некоторой температуре константа диссоциации йодовродорода на простые вещества равна 6,25·10-2. Какой процент HI диссоциирует при этой температуре? Ответ: 33,3%
171. В каком направлении сместится равновесие в системах а) СО(г.)+Сl2(г.)↔СОСl2(г.) б) 2HI(г.)↔H2(г.)+I2(г.), если при неизменной температуре увеличить давление газовой смеси.
172. Используя справочные данные, найти значение температуры, при которой константа равновесия реакции образования водяного газа равна единице. С(графит) + Н2О(г.) ↔ СО(г.) + Н2(г.). Ответ: 983 К.
173. Реакция идет по уравнению СО(г) + Н2О(г) = СО2(г) + Н2(г). Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]0= 3моль/л, [H2O]0 = 2моль/л. Ответ: [CO2] =1,2 моль/л; [H2] =1,2 моль/л; [CO] = 1,8 моль/л; [H2O] = 0,8 моль/л.
174. При некоторых условиях равновесие реакции СО+Н2О ↔ Н2 +СО2 установилось при следующих концентрациях: [СО]г=1 моль/л; [Н2О]г =4 моль/л; [Н2]г=2 моль/л; [СО2]г =2 моль/л. В какую сторону сместится равновесие при повышении концентрации СО в 3 раза? При какой концентрации установится новое равновесие? Ответ: [СО] =2,27 моль/л; [Н2О] = 3,27 моль/л; [СО2] = 2.73 моль/л; [Н2] = 2.73 моль/л
175. В каком направлении сместится равновесие в системе при понижении температуры и уменьшении объема: CO2 + C(Т) = 2 CO – Q. Ответ обосновать.
176. Реакция идет по уравнению H2 + I2 = 2HI. Константа скорости этой реакции при 5080С равна 0,16. Исходные концентрации реагирующих веществ были: [Н2] = 0,04 моль/л; [I2] = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [Н2] стала равной 0,03 моль/л. Ответ: V0 = 320 * 10-6; V = 182 * 10-6
177. Напишите выражение для константы равновесия гомогенной системы: N2 + H2 ↔.2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в 3 раза? Ответ: увеличится в 9 раз
178. Как изменится равновесие в системе при повышении температуры и давления в газовой смеси: PCl5 (Г) ↔ PCl3 (Г)+ Cl2(Г), ∆Н = 92,6? Ответ обосновать.
179. Как изменится скорость реакции 2NO(г) + O2(г) → 2NO2(г), если увеличить давление в системе в 3 раза? Ответ: увеличится в 27 раз
180. Реакция идет по уравнению N2 + 3H2 ↔.2NH3. Концентрации участвующих в ней веществ были [N2]0 = 0,8 моль/л, [H2]0 = 1,5 моль/л, [NH3]0 = 0,1 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [Н2] = 0,6 моль/л; [NH3] = 0,7 моль/л






