Этот закон был экспериментально установлен и имеет в настоящее время два практически важных следствия.
Согласно одному из них: Тепловой эффект реакции равен сумме теплот образования продуктов реакции 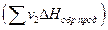 за вычетом суммы теплот образования исходных веществ
за вычетом суммы теплот образования исходных веществ 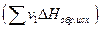 с учетом числа молей (v) всех участвующих в реакции веществ:
с учетом числа молей (v) всех участвующих в реакции веществ:
 (1.10)
(1.10)
В общем случае тепловой эффект 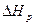 реакции типа:
реакции типа:
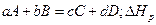
рассчитывается по уравнению

Согласно другому следствию, термохимические уравнения можно складывать, вычитать и умножать на численные множители.
В соответствии с законом сохранения энергии, система может самопроизвольно совершать "работу только за счёт собственной энергии, т.е. запас её внутренней энергии должен при этом уменьшаться или 𝛥U<0. В случае самопроизвольно протекающих химических реакций, это стремление к уменьшению запаса внутренней энергии может быть связано с выделением теплоты в виде экзотермического эффекта. Влияние этого фактора на направление самопроизвольного протекания различных процессов является одной из движущих сил химической реакции, а сам фактор называется энергетическим или энтальпийным. Но, наряду с ним, действует и другой фактор, иначе бы все химические реакции были экзотермическими. Этот фактор получил название структурного или энтропийного. Для понимания его природы необходимо рассмотреть ещё одну термодинамическую функцию состояния системы, получившую название «энтропия».
Мерой неупорядоченности или хаотичности системы в термодинамике служит энтропия (S). Обозначим энтропию исходного состояния данной системы как S1, энтропию конечного состояния как S2, а её изменение в процессе как 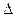 S = S2 - S1.Поскольку из опыта следует, что S2 > S1, то
S = S2 - S1.Поскольку из опыта следует, что S2 > S1, то 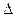 S >0. Стремление же различных термодинамических систем к увеличению энтропии называется структурным или энтропийным фактором и его преобладающим действием объясняется самопроизвольное протекание эндотермических процессов.
S >0. Стремление же различных термодинамических систем к увеличению энтропии называется структурным или энтропийным фактором и его преобладающим действием объясняется самопроизвольное протекание эндотермических процессов.
Энтропия зависит от всех видов движения частиц, составляющих систему, их количества, числа степеней свободы, агрегатного состояния и возрастает с повышением температуры. Поэтому в процессах, вызываемых увеличением движения частиц, т.е. при нагревании, испарении, плавлении, разрыве связей между атомами и т.п., энтропия возрастает. Наоборот, упрочнение связей, охлаждение, конденсация, кристаллизация, полимеризация, т.е. процессы, связанные с упорядочением системы, сопровождаются уменьшением энтропии.
Энтропия пропорциональна также массе вещества. Её обычно относят к одному моль вещества и выражают в Дж/моль*К.
Энтропия является функцией состояния системы.
Энтропия, отнесенная к стандартной температуре 25°С (298К) и стандартному давлению (1 атм), называется стандартной (S°298).
Одной из характерных особенностей энтропии в отличие от других термодинамических функций состояния является то, что можно определить её абсолютное значение. В термодинамических справочниках приводятся абсолютные значения стандартной энтропии веществ при 298 К на основании которых можно рассчитать стандартные энтропии тех или иных реакций.
Изменение энтропии системы в результате протекания химической реакции (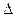 S) или энтропия реакции, как любой функции состояния системы, также не зависит от пути процесса, а определяется лишь энтропией начального и конечного состояний:
S) или энтропия реакции, как любой функции состояния системы, также не зависит от пути процесса, а определяется лишь энтропией начального и конечного состояний:
 (1.26)
(1.26)
При суммировании следует учитывать число молей (V) всех участвующих веществ. В общем случае изменение энтропии 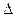 Sp в результате протекания химической реакции типа:
Sp в результате протекания химической реакции типа:

рассчитывается по уравнению
 (1.27)
(1.27)
ЭНЕРГИЯ ГИББСА
Для решения одной из основных задач химической термодинамики - установления принципиальной возможности самопроизвольного протекания процессов - необходимо иметь объективный количественный критерий. Выше было показано, что действующими силами в различных процессах (в том числе и химических) выступают две конкурирующие тенденции или два противоположных фактора:
1. Энергетический, или энтальпийный, обусловленный стремлением системы перейти в состояние с наименьшей энергией, например, при р=const понизить энтальпию (𝛥H< 0);
2. Структурный, или энтропийный, обусловленный стремлением системы перейти в состояние с максимальной степенью разупорядоченности, т.е. повысить энтропию (𝛥S>0).
Если в ходе реакции степень беспорядка не изменяется (𝛥S=0), то направление процесса определяется изменением энтальпии и процесс проходит самопроизвольно в направлении уменьшения энтальпии (𝛥H< 0).
Если процесс происходит без изменения энтальпии (𝛥H=0), то фактором, определяющим направление реакции, является энтропия и процесс пойдет самопроизвольно в сторону её увеличения (𝛥S >0).
Если одновременно изменяются и энтальпия, и энтропия, то направление самопроизвольного протекания процесса определяется суммарной движущей силой реакции. Самопроизвольно реакция протекает в том направлении, в котором общая суммарная движущая сила системы будет уменьшаться.
С учетом одновременного действия этих двух противоположных факторов, такой движущей силой (функцией состояния) для реакций, протекающих при постоянной температуре и давлении, является энергия Гиббса (G), называемая также изобарно-изотермическим потенциалом, или свободной энергией.
В качестве критерия для определения направления самопроизвольного протекания химических процессов (при р=const используется изменение энергии Гиббса 𝛥G или
𝛥G=G2- G1 (1.27)
В зависимости от знака её изменения, возможны три случая.
1. 𝛥G < 0, реакция термодинамически возможна.
При постоянной температуре и давлении химические реакции протекают самопроизвольно только в направлении уменьшения энергии Гиббса в системе (𝛥G < 0).
Это положение связано с принципом минимума энергии, лежащим в основе второго закона термодинамики, одна из формулировок которого гласит:
«Теплота не может самостоятельно переходить от менее нагретого тела к более нагретому, самопроизвольно возможен лишь обратный процесс».
2. 𝛥G > 0, реакция термодинамически невозможна;
3. 𝛥G = 0, термодинамически возможны как прямая, так и обратная реакция.
Отсутствие изменения энергии Гиббса является термодинамическим условием установления химического равновесия в реакционной системе.
Энергия Гиббса связана с энтальпией, энтропией и температурой следующим образом:
G=H-T*S
Изменение энергии Гиббcа (𝛥G) при этом записывается в виде:
𝛥G = 𝛥Н – Т𝛥S (1.28)
Из уравнения 1.28 следует, что возможность самопроизвольного протекания химических реакций зависит от соотношения величины 𝛥Н и Т𝛥S. При этом возможны четыре основных случая:
1. Если 𝛥Н < 0, а 𝛥S > 0, то энергия Гиббcа всегда будет величиной отрицательной (𝛥G < 0). Такие реакции термодинамически возможны при любой температуре.
2. Если 𝛥Н > 0, а 𝛥S < 0, то всегда 𝛥G > 0. Такие реакции термодинамически невозможны при любых температурах.
3. Если 𝛥Н > 0 и 𝛥S > 0, то реакция возможна только при высоких температурах, когда | 𝛥Н | < | Т𝛥S |.
4. Если 𝛥Н <0 и 𝛥S <0, то реакция возможна при низких температурах, когда | 𝛥Н | > | Т𝛥S |.
Для проведения различных термодинамических расчетов, также как и в случае других термодинамических функций, вводят специальное понятие: стандартная энергия Гиббcа образования вещества (𝛥G°обр.298). Это - изменение энергии Гиббса в реакции образования одного моля соединения из соответствующих простых веществ, когда все участвующие вещества находятся в стандартном состоянии, а реакция проходит при стандартных условиях (измеряется обычно в кДж/моль). При этом:






