а ) Розкладання амоній дихромату.
До порцелянової чашки внести невелику кількість кристалічного амоній дихромату (NH4)2Cr2O7 і запалити суміш. Через кілька секунд спостерігати розкладання солі. Написати рівняння реакцій.
б) Розкладання купрум(ІІ) нітрату.
В пробірку внести кілька кристалів Cu(NO3)2 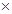 3Н2О. Закріпити пробірку в штативі і обережно нагріти в полум’ї пальника. Спостерігати зміну кольору солі та утворення газів. Скласти рівняння реакції, враховуючи, що продуктами реакції є купрум(ІІ) оксид, нітроген діоксид та кисень.
3Н2О. Закріпити пробірку в штативі і обережно нагріти в полум’ї пальника. Спостерігати зміну кольору солі та утворення газів. Скласти рівняння реакції, враховуючи, що продуктами реакції є купрум(ІІ) оксид, нітроген діоксид та кисень.
Дослід 3. Реакції диспропорціонування.
а) Внести в пробірку 5-7 крапель розчину йоду і додати до нього по краплям 2н розчин лугу до знебарвлення. Написати рівняння реакції взаємодії йоду з лугом, враховуючи, що при цьому утворюються солі йодидної (НІ) і йодитної (HІO) кислот. Вказати, як зміниться ступінь окиснення йоду. Які реакції називаються реакціями диспропорціонування?
б) В дві пробірки внести по 2–3 кристали натрій сульфіту. Пробірки нагріти протягом 5–6 хвилин. Охолодити їх, додати по 0,5 мл дистильованої води і розчинити кристали. В одну пробірку внести 2 -3 краплі купрум (ІІ) сульфату, в другу – барій хлориду. Спостерігати утворення осадів. Написати рівняння реакцій, враховуючи, що при розкладанні натрій сульфіту утворюється натрій сульфід і натрій сульфат.
Дослід 4. Вплив середовища на протікання окисно-відновних реакцій.
В три пробірки внести по 3-4 краплі розчину KMnO4. В одну пробірку додати 2-3 краплі 2н розчину H2SO4, в другу – стільки ж води, в третю – таку ж кількість розчину лугу. В три пробірки внести декілька кристаликів Na2SO3 і перемішати розчини до повного розчинення кристалів. Відмітити зміну забарвлення розчину в усіх трьох випадках.
Написати рівняння реакцій відновлення KMnO4 натрій сульфітом в кислому, нейтральному і лужному середовищах, маючи на увазі, що в кислому середовищі продукт відновлення – сіль Mn2+, в нейтральному – MnO2, в лужному – K2MnO4.
В якому середовищі Mn7+ поводить себе як найсильніший окисник?
Контрольні питання:
1. Які з наведених нижче реакцій відносяться до окисно-відновних?
Вказати для них окисник і відновник:
l Zn + H2SO4(розб.) = ZnSO4 + H2
l Zn + H2SO4(конц.) = ZnSO4 + SO2 + H2O
l Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
l CaO + CO2 = CaCO3
l Fe2O3 + CO = CO2 + 2FeO
2. Окиснення чи відновлення відбувається при переходах:
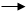

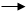
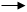
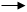 FeSO4 Fe2(SO4)3; Fe2O3 Fe; NH3 NO; 2Cl- Cl2; Cl- ClO-4;
FeSO4 Fe2(SO4)3; Fe2O3 Fe; NH3 NO; 2Cl- Cl2; Cl- ClO-4;
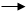 IO-4 I2
IO-4 I2
3.Як змінюються ступені окиснення окисника і відновника в окисно-відновних процесах? Навести приклади.
4.Які з наведених нижче речовин можуть проявляти тільки окисні властивості, тільки відновні властивості або окисні і відновні властивості одночасно: KMnO4, MnO2, V2O5, KI, PbO2, NH3, HNO2, Na2S, Na2SO3, HNO3, K2Cr2O7, PH3.
5.Розставити коефіцієнти в рівняннях реакцій, використавши метод електронного балансу:
l 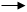 As2O3 + HNO3 + H2O H3AsO4 + NO
As2O3 + HNO3 + H2O H3AsO4 + NO
l 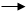 Fe2(SO4)3 + AsH3 As + FeSO4 + H2SO4
Fe2(SO4)3 + AsH3 As + FeSO4 + H2SO4
l  KIO4 + Na2SO3 + H2SO4 I2 + Na2SO4 + K2SO4 + H2O
KIO4 + Na2SO3 + H2SO4 I2 + Na2SO4 + K2SO4 + H2O
l  KMnO4 + Ca(NO2)2 + H2SO4 Ca(NO3)2 + MnSO4 + K2SO4 + H2O
KMnO4 + Ca(NO2)2 + H2SO4 Ca(NO3)2 + MnSO4 + K2SO4 + H2O
l  As2O3 + I2 + KOH KI + K3AsO4 + H2O
As2O3 + I2 + KOH KI + K3AsO4 + H2O
l  Bi2O3 + Cl2 + KOH KCl + KBiO3 + H2O
Bi2O3 + Cl2 + KOH KCl + KBiO3 + H2O
l  KClO3 + I2 + H2O HIO3 + KCl
KClO3 + I2 + H2O HIO3 + KCl
l  Zn + HNO3 SO2 + NH4NO3 + H2O
Zn + HNO3 SO2 + NH4NO3 + H2O
l  Ag + H2SO4(конц.) SO2 + Ag2SO4 +H2O
Ag + H2SO4(конц.) SO2 + Ag2SO4 +H2O
Лабораторна робота № 6






