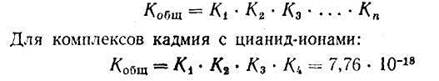Константа нестойкости комплекса
Внутренняя и внешняя сферы комплексного соединения сильно различаются по устойчивости; частицы, находящиеся во внешней сфере, связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. Эта диссоциация называется первичной, она протекает почти нацело, по типу диссоциации сильных электролитов. Поэтому с помощью качественных химических реакций обычно обнаруживаются только ионы внешней сферы.
Лиганды, находящиеся по внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в небольшой степени. Обратимый распад внутренней сферы комплексного соединения носит название вторичной диссоциации (протекает по типу слабых электролитов). Например, диссоциацию комплекса [Ag(NH3)2]Cl имеет вид:
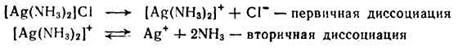
Вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами
Диссоциация ионов [Ag(NH3)2]+, согласно приведенному выше уравнению, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой равновесия, называемой константой нестойкости комплексного иона:
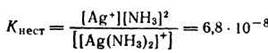
С учетом активности ионов уравнение констант нестойкости принимает следующий вид:

Полученная константа Ка называется термодинамической константой нестойкости.
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса. Чем устойчивее комплексный ион, тем меньше его константа нестойкости. Так, среди однотипных соединений, обладающих различными значениями констант нестойкости
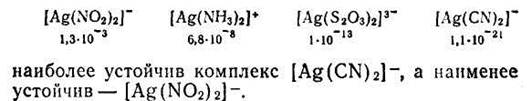
Величина, обратная константе нестойкости, называется общей или суммарной константой устойчивости. Следовательно,
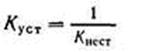
Последняя также характеризует устойчивость комплексных ионов.
Если ионизация комплексных ионов происходит по ступеням, то константы равновесия этих промежуточных реакций называются промежуточными или ступенчатыми константами нестойкости. Например, для комплексов кадмия с цианид-ионами известны следующие промежуточные константы нестойкости, которые нумеруются в порядке возрастания числа лигандов, связанных с центральным атомом комплекса, ионизирующего на одну ступень:
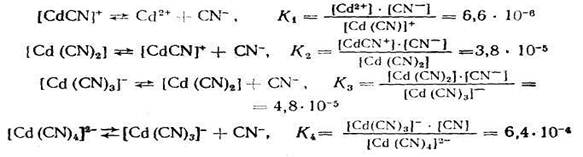
Однако практически пользуются общей суммарной константой нестойкости, равной произведению промежуточных констант нестойкости: