Адсорбция на границе раствор – пар.
В жидких растворах поверхностное натяжение σ является функцией от концентрации растворенного вещества. На рис. 6.3 представлены три возможных зависимости поверхностного натяжения от концентрации раствора (изотермы поверхностного натяжения).

Рис. 6.3. Изотермы адсорбции поверхностного натяжения поверхностно-инактивных веществ (кривая 1, 2) и поверхностно-активных веществ (3)
Ориентация молекул ПАВ в поверхностном слое. На границе раздела фаз молекулы ПАВ ориентированы полярной головой в сторону полярной фазы, неполярным хвостом в сторону неполярной фазы.

При достижении максимального значения адсорбции молекулы ПАВ строго ориентированы и образуют плотный мономолекулярный слой (частокол Лэнгмюра). Это позволяет объяснить существование предельного значения адсорбции Гmax. Зная площадь поверхности и максимальную адсорбцию Гmax (число молей ПАВ на 1 м2), можно рассчитать размер молекулы.
S = 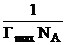 – площадь поперечного сечения молекулы ПАВ
– площадь поперечного сечения молекулы ПАВ
Факторы, влияющие на адсорбцию веществ - природа адсорбента, адсорбата и растворителя; на неполярном адсорбенте лучше адсорбируется неполярное вещество из полярного растворителя, а на полярном - полярное вещество из неполярного растворителя; чем лучше растворяется в данном растворителе адсорбат, тем хуже он из него адсорбируется; если растворимость вещества увеличивается с повышением температуры, то величина молекулярной адсорбции уменьшается. Если растворимость вещества уменьшается с повышением температуры, то величина адсорбции увеличивается с повышением температуры; адсорбция прямо пропорциональна удельной поверхности адсорбента; адсорбция зависит от концентрации адсорбата в растворе и описывается уравнением Фрейндлиха и Лэнгмюра.
Уравнение Фрейндлиха:

где K - константа, численно равная адсорбции при равновесной концентрации, равной единице; n - константа, определяющая кривизну изотермы адсорбции, ее значение колеблется в пределах от 0,1 до 0,6.
Уравнение Фрейндлиха применимо при средних значениях равновесных концентраций. Для нахождения констант его логарифмированием приводят к уравнению прямой: lgKф + nlgc;
Уравнение Лэнгмюра:

где Г - адсорбция, моль/г; Г∞ - предельная адсорбция: количество адсорбата, покрывающего поверхность адсорбента плотным монослоем. Характеризует адсорбционную способность адсорбента; α - константа адсорбционного равновесия, отражает способность адсорбата адсорбироваться, равна отношению констант скоростей десорбции и адсорбции; с - концентрация вещества в растворе, моль/л.
Адсорбцию характеризуют количеством молей или массой вещества, накапливающегося на границе раздела фаз в расчете на единицу массы адсорбента (моль/г) или на единице площади поверхности раздела фаз (моль/см2 или г/см2).
Ионообменная адсорбция - это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из жидкого раствора.
Такой обменный ионный процесс аналогичен обменным химическим реакциям, но только протекает на поверхности твердой фазы.
Ионообменная адсорбция имеет следующие особенности:
· специфична, т.е. к обмену способны только определенные ионы;
· не всегда обратима;
· протекает более медленно, чем молекулярная адсорбция;
· может приводить к изменению рН среды.
Вещества, проявляющие способность к ионному обмену, называются ионитами. В зависимости от того, какой вид ионов участвует в обмене, иониты подразделяются на катиониты и аниониты. Катиониты способны обменивать катионы, в т.ч. ион Н+, аниониты – анионы, в т.ч. ион ОН–. Существуют также амфолиты, которые в зависимости от условий способны проявлять как катионообменные, так и анионообменные свойства.
Иониты имеют структуру в виде каркаса, «сшитого», обычно, ковалентными связями. Каркас имеет положительный или отрицательный заряд, скомпенсированный противоположным зарядом подвижных ионов (противоионов), которые могут легко заменяться на другие ионы с зарядом того же знака. Каркас выступает в роли полииона и обусловливает нерастворимость ионита в растворителях.
Различают природные и синтетические иониты. Природные: алюмосиликатные материалы – гидрослюда, цеолиты и т.д. Синтетические: ионообменные смолы, сульфитированные угли, ионообменные целлюлозы.
Ионный обмен широко применяется в различных отраслях промышленности. Иониты применяют для очистки сточных вод, умягчения и обессоливания воды, при производстве сахара, молока (для изменения его солевого состава), вина (для предотвращения помутнения и понижения кислотности).
Адсорбцию подразделяют:
а) на физическую – это адсорбция, вызванная вандерваальсовыми силами взаимодействия (невысокий тепловой эффект). При физической адсорбции между адсорбентом и адсорбатом происходит только межмолекулярное взаимодействие, т.е. сцепление достаточно непрочное, и со временем начинается обратный процесс − десорбции;
б) хемосорбцию – это адсорбция, сопровождающаяся химическим взаимодействием адсорбента с поглощаемым веществом (возникают химические связи, значительный тепловой эффект).
При химической адсорбции (хемосорбции) между адсорбентом и адсорбатом возникает химическое взаимодействие, в результате чего между ними образуется третье вещество (рис. 6.4):
4Al + 3O2 → 2Al2O3

Рис. 6.4. Хемосорбция
Химическая сорбция намного прочнее физической. Ещё одно отличие между физической и химической сорбцией заключается в том, что при повышении температуры физическая адсорбция уменьшается, а химическая увеличивается.
В чистом виде физическая и химическая адсорбция встречаются редко, чаще всего адсорбция включает элементы их обеих.
Адсорбция протекает самопроизвольно − энергия Гиббса при адсорбции имеет отрицательное значение: DGадс<0. Тепловой эффект имеет отрицательное значение DНадс<0. В то же время в процессе адсорбции происходит упорядочение адсорбированных частиц: DSадс<0.
При физической адсорбции с увеличением температуры энергия Гиббса системы возрастает и при некоторой Тр наступает равновесие:
адсорбция
 A Aадс
A Aадс
Десорбция
При повышении температуры равновесие сдвигается в сторону десорбции. Таким образом, вещество можно адсорбировать при невысокой температуре и десорбировать при более высокой температуре.






