Биокомплексных соединений
Металлоферменты – это ферменты класса протеидов, для каталитического действия которых необходимы ионы металлов. Например, фермент каталаза, разрушающий перекись водорода (2Н2О2 → 2Н2О + О2), выполняет важную функцию в работе ферментативной антиоксидантной системы перовой линии защиты, обезвреживая активные формы кислорода, является железосодержащим ферментом.
Транспорт О2 в организме животных и человека осуществляется железосодержащими комплексами - гемоглобином и миоглобином. Это представители сложных белков, содержащие помимо белковой части, состоящей из аминокислотных остатков, небелковую часть – гем: порфириновый комплекс железа. Гем – это тетрапиррол (4 пиррольных кольца соединены метеновыми мостиками с образованием структуры - гема). В центре гемма содержится Fe2+, которое образует 4 координационные связи с атомоами азота пиррольных колец, 5 связь – с аминокислотой гистидин, расположенной в 8 положении спирали F белковой части гемоглобина или миоглобина (сокращенно, гис F8) – это связь белковой и небелковой части молекулы,, и 6 координационная связь образуется при присоединении молекуля кислорода к дезоксимио(гемо)глобину с образованием оксимио(гемо)глобина.
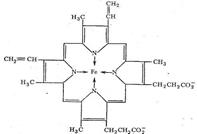
Созданию оптимального угла взаимодействия железа с кислородом, равного 120°, служит наличие в белковой части молекул мио- или гемоглобина гистидина Е7. В противном случае с атомом железа связывался бы СО (угол взаимодействия = 180°), который имеет более выраженное сродство к железу, чем кислород.
Таким образом, в координационную сферу иона железа входит пять атомов азота (четыре атома азота порфирина, один атом азота белкового гистидина). Шестое координационное место занимает О2.
Гемоглобин состоит из 4 субъединиц (имеет четвертичный уровень организации белковой части) и включает четыре гем-группы. Миоглобин сходен с гемоглобином по строению, но содержит только одну субъединицу (третичный уровень организации белковой части молекулы) и одну гем-группу. Гемоглобин является транспортером кисорода по крови, а миоглобин – запасает кислород в красных мышцах.
Теряя кислород, железо в гемоглобине (форма дезоксигемоглобина, КЧ железа = 5) переходит в высокоспиновое состояние. Ослабление связи с атомами азота порфирина приводит к выходу атома железа из плоскости кольца порфирина (на 0,7-0,8Ǻ). Напротив, вследствие присоединения кислорода к гемоглобину образуется низкоспиновый октаэдрический комплекс, железо в котором находится в плоскости порфиринового кольца (КЧ железа = 6). Хотя связывание молекулярного кислорода гемоглобином и миоглобином сопровождается ослаблением связи O=O в молекулярном кислороде из-за размещения π-дативных электронов железа на разрыхляющих орбиталях О2, этот процесс сам по себе не сопряжен с необратимым переносом электрона, поэтому его обычно не причисляют к ферментативным окислительно-восстановительным реакциям. Однако, разрыхление связи O=O не может не активировать окислительные реакции.
Связь кислорода с железом в макроциклическом комплексе молекулы гемоглобина не очень прочная и поэтому кислород в организме легко реагирует с восстановителями. Связывание гемоглобина молекулами угарного газа (СО) является аналогичным примером разрушения одного биокомплекса - оксигемоглобина за счет формирования в 300 раз более прочного другого биокомплекса – карбоксигемоглобина:
HbO2 + CO → HbCO + O2.
Недостаток железа в организме приводит к железодефицитной анемии.
Из других значимых в биологическом отношении комплексных соединений следует выделить витамин В12, участвующий в кроветоворении, синтезе ДНК и РНК, синтезе миелина и т.д.
К числу ферментов, катализирующих окислительно-восстановительные реакции, относятся гемсодержащие ферменты - цитохромы. Атомы железа в цитохромах, так же как в гемоглобине и миоглобине, координируют пять атомов азота (порфирина и гистидина), шестое координационное место занимает атом серы аминокислоты - метионина. Известно 50 видов ферментов этого типа, несколько различающихся по составу органической его части. Железо в цитохромах играет роль переносчика электронов - оно принимает электроны от восстановителя и передает их окислителю. Окислителем может быть и кислород, но он не участвует в координации железа, входящего в состав цитохромов, поскольку железо в цитохроме имеет полностью насыщенную координационную сферу. Так, цитохромы содержатся в дахательной цепи митохондрий, являясь переносчиками электронов; участвуют в обезвреживании токсических веществ в печени, превращая гидрофобные токсины в гидрофильные, способные поступать в желчь и затем с калом покидать организм.






