Серед сполук хіноліну є також ефективні препарати з місцевою анестезуючою дією. З похідних 8-оксихіноліну фармакопейним препаратом є хінозол (8-оксихіноліну сульфат). Препарат добувають, виходячи з фенолу, за такою схемою:

Реакція конденсації о -амінофенолу з гліцерином при наявності сульфатної кислоти і оксидаторів має назву синтезу Скраупа. Хінозол також добувають сульфуванням хіноліну та сплавленням утвореного 8-сульфохіноліну з NаОН. Хінозол – дрібнокристалічний порошок цитриново-жовтого кольору, із специфічним запахом. Легко розчинний у воді, мало – у спирті, нерозчинний в ефірі і хлороформі. Плавиться при температурі 175-178° С.
Феруму(ІІІ) хлорид забарвлює водний розчин препарату в зелений колір (наявність ОН-групи фенольного характеру). Барію хлорид осаджує білий осад барію сульфату (наявність іонів SО42-).
При додаванні до розчину препарату розчину натрію карбонату утворюється спочатку осад 8-оксихіноліну, який розчиняється в надлишку Nа2СО3 з утворенням натрієвої солі.
Кількісне визначення полягає в титруванні препарату 0,1н розчином лугу при наявності хлороформу (розчиняє оксихінолін і усуває його з середовища) та індикатора фенолфталеїну. Кількісний вміст хінозолу можна визначити і гравіметричним методом, шляхом взаємодії його з барію хлоридом. Ваговою формою буде в цьому випадку ВаSО4.
Можна, також, застосувати спектрофотометричний метод для кількісного визначення хінозолу.
Застосовується хінозол як антисептичний засіб у вигляді розчинів 1:1000 або 1:2000 для дезинфекції рук, промивання ран, виразок та для спринцювань. Входить до складу протизаплідного препарату хіноцептину.
Препарат застосовується і як місцевий кровоспинний засіб у вигляді 5-10%-вих мазей і 1-2%-вих присипок.
Хінозол не можна застосовувати для дезинфекції хірургічних інструментів, бо з металами він утворює нерозчинні сполуки. Зберігати хінозол необхідно в добре закритій тарі.
Цікавими для медицини є галагенопохідні хінозолу, які крім антисептичної проявляють також антипротозойну дію. Найбільш цікавим представником цієї групи є йодовмісні похідні, які мають специфічну активність проти збудників амебної дизентерії.
До цих препаратів відносяться ентеросептол і хініофон.

Ентеросептол – це 5-хлор-7-йод-8-оксихінолін. Виробляється в Угорщині, але широко використовується вітчизняною медициною. Специфічна дія цих препаратів обумовлена присутністю галогенів у молекулі.
Ентеросептол особливо ефективний при кишкових захворюваннях (дизентеріях). Він повністю зв’язує іонний кобальт і життя бактерій стає неможливим.
Ентеросептол – жовтуватий порошок, плавиться при температурі 172°С, нерозчинний у воді, легкорозчинний у спирті. Випускають у вигляді таблеток по 0,22 г, застосовують при хронічній бацилярній дизентерії, протозойних і хронічних виразкових колітах, амебіазі і трихомонадних кольпітах.
Хімофон ( 8-окси-7-йодхінолін-5-сульфокислота), ятрен є вітчизняним препаратом. Він описаний в ДФ X і застосовується як противоамебний засіб.
Хініофон – жовтий кристалічний порошок, нерозчинний в органічних розчинниках, не розчиняється у воді, а при наявності натрію гідрокарбонату переходить в розчин. При нагріванні препарату з нітратною кислотою виділяються фіолетові пари йоду. Барію хлорид осаджує з водного розчину препарату жовтий осад ВаСО3, колір якого обумовлений наявністю в ньому домішки 8-окси-7-йод-5-сульфохіноліну. З феруму (ІІІ) хлоридом препарат дає зелене забарвлення (наявність фенольного гідроксилу). 3 концентрованого водного розчину препарату хлорна кислота осаджує жовтий кристалічний осад вільного 8-окси-7-йод-5-сульфохіноліну.
Кількісне визначення полягає у відновленні препарату цинковим пилом при наявності оцтової кислоти та титруванні утворених іонів йоду 0,1н розчином АgNО3 за наявності індикатора натрію еозинату.
Хініофон застосовують при амебній дизентерії, виразкових колітах, гнійних ранах, опіках тощо. Для зовнішніх цілей застосовують 0,5-3%-ві розчини, 5-10%-ві мазі та 10%-ві присипки. Для лікування ревматизму вводять внутрішньо або підшкірно по 5 мл 5%-вого розчину.
Питання для самоконтролю
8. Чому сам по собі хінолін не використовується в медицині?
9. Які похідні хіноліну застосовують в медичній практиці?
10.Якими способами добувають хінозол?
11.Перечисліть реакції, якими можна доказати тотожність хінозолу.
12.Приведіть методи кількісного визначення хінозолу.
13.Які препарати, похідні хінозолу, застосовуються в медицині?
Тестові завдання
1. В медицині не використовується через високу токсичність:
| A) хінозол; | B) нітроксолін; |
| C) хінолін; | D) 8-амінохінолін. |
2. В надлишку Nа2СО3 розчиняється:
| A) хінозол; | B) ентеросептол; |
| C) хініофон; | D) 8-гідроксихінолін. |
3. Одна з приведених формул відповідає нітроксоліну:
A)
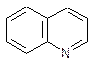
| B)
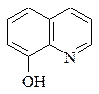
|
C)

| D)

|
4. Який препарат з похідних хіноліну дає з FеСІ3 чорно-зелене забарвлення:
| A) нітроксолін; | B) ентеросептол; |
| C) хінозол; | D) 8-амінохінолін. |
5. Введення якої групи розширює антибактеріальний спектр дії препарату:
| A) ОН; | B) F; |
| C) NO2; | D) Cl. |
ЛІКАРСЬКІ РЕЧОВИНИ З ГРУПИ АЛКАЛОЇДІВ
Алкалоїди – велика група органічних речовин основного характеру, головним чином рослинного, а рідше тваринного походження.
Вони мають складну хімічну будову, основою якої є різні гетероциклічні ядра, що містять нітроген. Наявність нітрогену і зумовлює основний характер цієї групи речовин. Алкалоїди є продуктами життєдіяльності рослин і більшість з них виявляє сильну фізіологічну дію.
Більшість алкалоїдів існують в природі у вигляді солей кислот: лимонної, щавлевої, малонової, янтарної; рідше – оцтової, пропіонової, молочної, фосфатної, сульфатної і дуже рідко – фумарової, хелідонової, меконової, хінної.
Як правило, у рослинах містяться суміші кількох алкалоїдів. Так, з опію виділено 22 алкалоїди, з хінної кори – 24, з листків кока – 4, з листків тютюну – 10 і т.д. Найчастіше алкалоїди, що містяться в одній рослині, мають подібну структуру.
Кількість алкалоїдів у рослині невелика і при вмісті 1 – 2 % алкалоїдів рослинну сировину розглядають як придатну для промислової переробки. В окремих випадках вміст алкалоїдів у деяких частинах рослин може бути дуже високим. Так, в корі культивованих видів хінного дерева вміст хініну досягає 7 – 10 % (часом навіть 15%).
Фізичні властивості
Вільні алкалоїди – це найчастіше кристалічні тверді речовини, що не розчиняються у воді, легко розчиняються в спирті, хлороформі, бензолі та інших органічних розчинниках. В ефірі деякі алкалоїди (наприклад, морфін) дуже мало розчиняються
Більшість солей алкалоїдів легко розчиняються у воді і не розчиняються в бензолі, ефірі та хлороформі, спирт розчиняє солі алкалоїдів при нагріванні.
Добування
При виділенні солей алкалоїдів з рослинної сировини треба їх відділити від вуглеводів, білків, дубильних речовин, смол та ін.
Для виділення існують такі методи:
1. Виділення у вигляді вільних алкалоїдів – основ.
2. Виділення у вигляді солей.
При виділенні алкалоїдів у вигляді основ подрібнену сировину змочують розчинами аміаку, лугу, соди або гашеного вапна; виділені вільні алкалоїди екстрагують органічними розчинниками (хлороформом, дихлоретаном, бензолом, гасом, тощо). Пропускаючи розчинники декілька раз через рослинну сировину, добувають екстракти досить багаті на алкалоїди. В екстракти попадають крім алкалоїдів, барвники, вітаміни, смоли та інші речовини. При збовтуванні екстрактів з водними розчинами НСІ або H2SO4 алкалоїди переходять у вигляді солей у водні розчини, а в органічному розчиннику залишаються баластні речовини.
За другим методом рослинну сировину екстрагують розбавленими мінеральними або органічними кислотами. У цьому випадку екстракт містить солі алкалоїдів разом з вуглеводами, барвниками, глікозидами тощо.
Часто баластні речовини виділяють, обробляючи суміш розчином Рb(СН3СОО)2 або іншими реактивами. З розчину солей вільні алкалоїди виділяють лугами. Виділені алкалоїди відфільтровують або екстрагують органічними розчинниками.
Очищення алкалоїдів і розділення суми алкалоїдів проводять з використанням:
1) дробної перегонки під вакуумом;
2) різної розчинності солей та основ;
3) різної основності алкалоїдів;
4) особливих хімічних властивостей;
5) хроматографії;
6) методу протиточного розділення.
Тотожність
Для підтвердження тотожності алкалоїдів використовують загальні, групові та специфічні реакції.
Загальні реакції проводять із загальноалкалоїдними осаджувальними і спеціальними реактивами.
Загальні осадові реакції грунтуються на здатності алкалоїдів як основ утворювати прості або комплексні солі з різноманітними кислотами або солями важких металів. Ці продукти, як правило, нерозчинні у воді, тому реактиви називаються осаджувальними.
Загальні алкалоїдні реактиви:
1. Реактив Люголя, Бушарда або Вагнера – КІО3 (І2 в розчині КІ різної концентрації).
2. Реактив Драгендорфа (розчин бісмуту йодиду в калію йодиді –К[ВіІ4]).
3. Реактив Майєра (розчин меркурію йодиду в КІ – К2[HgI4]).
4. Розчин кадмію йодиду в КІ - К2[Cd I4].
5. Реактив Зоненштейна – фосфорномолібденова кислота H3PO4∙12MoO3∙2H2O, чутливий реактив на алкалоїди. Він дає аморфні осади жовтуватого кольору, які через деякий час набувають синього або зеленого забарвлення (внаслідок відновлення молібденової кислоти).
6 Реактив Шейблера – фосфорновольфрамова кислота Н3 РО4∙12WO3 ∙2H2O.
7. Реактив Бертрана – кремній-вольфрамова кислота SiO2∙12WO3∙4 H2O.
8. Свіжовиготовлений розчин таніну (5%-ний).
Насичений розчин пікринової кислоти. 

Перераховані реактиви утворюють осади не з усіма алкалоїдами, тому при дослідженні препаратів на наявність алкалоїдів треба провести 5-6 проб.
Спеціальні алкалоїдні реактиви:
1. Концентрована сульфатна кислота.
2. Концентрована нітратна кислота.
3. Реактив Ердмана – суміш конц. Н2SO4 з невеликою кількістю HNO3.
4. Реактив Фреде (розчин МоО3 в концентрованій H2SO4).
5. Реактив Маркі (конц. Н2SO4, яка містить невелику кількість формальде-гіду);
6. Реактив Вазіцкі (розчин п-диметиламінобензальдегіду (СН3)2N─C6H4─CHO в концентрованій H2SO4).
Для деяких алкалоїдів ці реакції можуть бути специфічними; викоують їх з кристалічними речовинами у фарфорових чашках.
Кількісне визначення
Для кількісного визначення алкалоїдів використовують:
1. Метод ацидиметрії в неводному середовищі як основ, так і солей.
2. Методи кислотно-основного титрування.
3. Гравіметричний метод.
4. Методи, що грунтуються на індивідуальних хімічних властивостях алка-лоїдів.
Алкалоїди поділяють на групи, залежно від способу зв’язування атома нітрогену в їх молекулах.
Найважливішими групами алкалоїдів є: 1) алкалоїди – похідні тропану (атропін, гіосціамін, скополамін, кокаїн) 2) алкалоїди хіноліну (хінін) і ізохіноліну (опійні алкалоїди); 3) алкалоїди хінолізидину і хінолізину (цитизин, пахікарпін); 4) похідні імідазолу (пілокарпін); 5) похідні індолу (гармін, стрихнін, резерпін); 6) алкалоїди – похідні пурину (кофеїн, теобромін, теофілін); 7) алкалоїди – похідні 1-метилпіролізидину (платифілін); 8) алкалоїди з екзоциклічним нітрогеном (який не входить до циклу) (сферофізин, ефедрин; 9) стероїдні алкалоїди (в лікарській справі не застосовуються; 10) аконітові алкалоїди поліциклічної будови (меліктин, кондельфін).
Похідні тропану
Тропан – конденсована система з двох гетероциклів піперидинового і піролідинового з метильною групою при атомі нітрогену: спільними для двох циклів є атоми в положенні 1,5,8.
Алкалоїди групи тропану поділяють на дві підгрупи: 1) похідні аміноспирту тропіну (атропін, гіосціамін, скополамін); 2) похідні оксиамінокислоти екгоніна (кокаїн).
Похідні тропану є важливими лікарськими засобами. До них належать хінолітики, засоби проти паркінсонізму, антиадренергічні засоби та ін.

 Атропіну сульфат (Atropini sulfas)
Атропіну сульфат (Atropini sulfas)
Тропінового ефіру-d,l-тропової кислоти сульфат моногідрат або
(R,S)-3-тропоілокситропану сульфат моногідрат.
Атропіну сульфат – білий кристалічний або зернистий порошок без запаху. Легко розчинний у воді і в спирті.
Атропін добувають з різних рослин (блекоти, беладонни). Атропіну в рослинах дуже мало. В рослинах міститься лівообертаючий ізомер – гіосціамін. Атропін утворюється з гіосціаміну при температурі 114-116˚С в вакуумі, або при дії спиртового розчину лугу. З рослинної сировини екстрагують алкалоїди бензолом або дихлоретаном
 |
З добутого екстракту алкалоїди переводять у солі дією розбавленої НСІ. Гідрохлориди алкалоїдів (гіосціамін, атропін, скополамін і ін.) розділяють хроматографічно
Скополаміну гідробромід (Scopolamini hydrobromidum)
Скопінового ефіру (-) тропової кислоти гідробромід тригідрат.
Скополаміну гідробромід – безбарвні прозорі кристали або білий кристалічний порошок, легко розчинний у воді, розчинний у спирті.
В медицині використовуються синтетичні і напівсинтетичні холіноблокатори, модифіковані по кислотному фрагменту: гоматропіну гідроброміду, тропацин, тропафен(виражений β-адреноблокатор). Синтетичні холіноблокатори, модифіковані по спиртовому гідроксилу – тровентол (бронхорозширювальний засіб).
Хімічні властивості і аналіз якості
Всі наведені вище лікарські речовини групи тропану і екгоніну є солями третинних або четвертинних амонієвих основ, тому для всіх характерна взаємодія з загальноалкалоїдними осаджувальними реактивами.
Виділення нерозчинних основ з водних розчинів лікарських речовин солей групи тропану проводять додаванням розчину аміаку. Застосування для осадження основ водних розчинів лугів небажане, тому що при цьому відбувається гідроліз препаратів як складних ефірів.
Як складні ефіри вказані препарати вступають в реакцію гідроксамової проби, гідролітичного розщеплення і переетерифікації.
Реакція Віталі-Морена характерна для складних ефірів деяких ароматичних кислот. Її виконання: до декількох кристалів препарату в фарфоровій чашці додають 3-4 краплини нітратної кислоти концентрованої і випарюють досуха. Залишок змочують декількома краплинами спиртового розчину гідроксиду калію і ацетону, виникає фіолетове забарвлення:
 |
Атропін Динітроатропін
 |
Нітроапоатропін
 |
При нагріванні препарату з концентрованою нітратною кислотою відбувається нітрування ароматичного кільця в 4-му положенні і одночасно - етерифікація спиртового гідроксилу. Від одержаного динітроатропіну легко відщеплюється молекула води і утворюється нітроапоатропін, який в лужному середовищі знову приєднує воду, перетворюючись на нітроатропін. Нітроатропін в лужному середовищі утворює барвник азооксанолового типу:
В реакцію вступають складні ефіри, але не кислоти.
Кількісне визначення
Кількісне визначенняатропіну і скополаміну за ДФ проводять методом кислотно-основного титрування в середовищі льодяної оцтової кислоти (титрант – 0,1 М розчин хлорної кислоти). При титруванні скополаміну гідроброміду додають меркурію(П) ацетат.
Зберігання
Атропіну сульфат і скополаміну гідробромід зберігають за списком А в щільно закритій тарі.
Застосування
Застосовуютьатропіну сульфат (0,5-1% розчини) в очній практиці для розширення зіниць, а також як протиотрута при отруєнні ацетилхоліном, карбахоліном, фосфорорганічними сполуками (0,1% розчин внутрівенно), для лікування виразкової хвороби шлунка і дванадцятипалої кишки, холециститу, бронхіальної астми, жовчокам’яної хвороби, спазмів кишківника і жовчних шляхів. Приймають як спазмолітик.
Скополаміну гідробромід викликає розширення зіниці ока (як атропін), виявляє холінолітичну дію, седативний ефект. В психіатричній практиці використовують як заспокійливий засіб, в неврології – при лікуванні паркінсонізму, у хірургії – для підготовки до операції.
Похідні хіноліну: хінін та його солі
Хінолін – бенз[b]піридин – міститься в молекулі алкалоїду хінного дерева. В корі хінного дерева, крім хініну, є ще 30 алкалоїдів. Більшість похідних хіноліну можна розділити на 4 групи: похідні цинхонану, 8-оксихіноліну, 4-амінохіноліну і 4-хінолону.
 |
Хінолін Хінідин
Гетероциклічна система цинхонану лежить в основі хімічної будови хініну і його оптичного ізомера хінідину.
До складу молекули хініну входить хіноліновий цикл, у положенні 6 якого міститься метоксильна група. В положенні 4 хінолінового циклу міститься карбінольна група - СНОН, яка зв’язує хіноліновий цикл з хінуклідиновим. Хінуклідиновий цикл можна розглядати як два конденсовані піперидинові цикли, що мають чотири спільні атоми.
 |
В положенні 3 хінуклідинового циклу молекули хініну міститься вінільна група. Повна назва хініну така: 3-вінілхінуклідил-8-6′- метоксихінолін-4′-карбінол. Хінін є двокислотною основою і тому може утворювати одно- і двозаміщені солі:
Більш вираженим центром основності є ядро хінуклідину, де неподілена пара електронів локалізована на гетероатомі нітрогену. Препарати хініну використовуються як антималярійні, антипіретичні ЛЗ. Хінін є також стимулятором мускулатури матки. В ДФУ включені наступні лікарські речовини: хініну гідрохлорид, хініну сульфат і хініну дигідрохлорид.
Хімічні властивості і аналіз якості
Хініну гідрохлорид – білий дрібнокристалічний порошок без запаху, дуже гіркий на смак.Розчинний у воді, рН водного розчину 6,0 – 7,0.
Хініну сульфат – білий дрібнокристалічний порошок без запаху, гіркий на смак. Малорозчинний у воді, рН суспензії 5,7 – 6,6.
Хініну дигідрохлорид – білий кристалічний порошок без запаху, дуже гіркий на смак. Дуже легко розчинний у воді, рН водного розчину 4,0 – 6,4.
Як солі азотистих основ, препарати хініну взаємодіють з загальноалкалоїдними реактивами.
Загальногруповою реакцією алкалоїдів групи 6′-метоксицінхоніну є талейохінна проба. Інші алкалоїди хінної кори, які не мають замісників в 6′-положенні, в цю реакцію не вступають. Для проведення реакції, до водного розчину солі хініну додають хлорну або бромну воду, а потім розведений розчин аміаку; з’являється зелене забарвлення.
Фармакопейним випробуванням тотожності є також флюоресценція хініну в розчинах оксигеновмісних кислот (сульфатної, оцтової і ін.)
ДФ регламентує також визначення питомого обертання препаратів хініну в розчині соляної кислоти.
Якщо до спиртового розчину хініну сульфату, підкисленого сульфатною кислотою, додати кілька крапель спиртового розчину йоду, то випадуть зелені лусочки герпатиту (С20Н24О2N2∙3H2SO4∙2HI∙ I4∙ 6H2O).
Кількісне визначення за ДФ проводять гравіметрично: виділяють натрію гідроксидом основу, екстрагують її хлороформом, відганяють хлороформ, висушують і зважують.
Похідні бензилізохіноліну: папаверіну гідрохлорид
Широке застосування в медицині похідних ізохіноліну пов’язано з вивченням алкалоїдів маку снодійного. Сік зелених головок маку містить біля 25 алкалоїдів: морфін, кодеїн,наркотин, папаверин та ін.
 |
Папаверину гідрохлорид (Papaverini hydrochloridum)
Фізичні властивості
Папаверину гідрохлорид – білий кристалічний порошок без запаху. Розчинний в хлороформі, помірно розчинний у воді, малорозчинний у спирті.
Лікарська речовина легко окиснюється на світлі і в присутності іонів важких металів. Окиснення іде по метиленовому фрагменту. Першими продуктами окиснення є спирт папаверинол і кетон папаверальдін.
Тотожність
В основі реакцій ідентифікації лежить здатність папаверіну гідрохлориду до окиснення.
При додаванні до папаверіну гідрохлориду сильних окислювачів і нагріванні утворюються продукти різного забарвлення. Так, взаємодія з кислотою НNO3 концентрованою приводить до появи жовтого забарвлення, яке переходить в оранжево-червоне при нагріванні.
Нагрівання з концентрованою H2SO4 приводить до утворення продукту, забарвленого в фіолетовий колір.
Відомі і інші реакції окиснення папаверіну. При взаємодії з реактивом Маркі виникає жовте забарвлення, яке переходить в оранжеве. При дальшому додаванні бромної води і розчину аміаку утворюється брудно-фіолетовий осад, який розчиняється в етанолі з утворенням розчину, забарвленого в фіолетовий або червоно-фіолетовий колір.
 |
Однією з відомих реакцій на папаверін є каролінова проба: до порошку папаверіну гідрохлориду додають концентровану H2SO4, оцтовий ангідрид і нагрівають. Виникає яскраво-жовте забарвлення з зеленою флюоресценцією:
Кількісне визначення
Кількісне визначення папаверіну гідрохлориду проводять в середовищі оцтового ангідриду і мурашиної кислоти; титрант 0,1 М розчин кислоти хлорної.
Застосування
Застосовують як спазмолітичний засіб при гіпертонії, стенокардії, мігрені, холециститі, спастичних колітах, спазмах сечових шляхів, бронхіальній астмі тощо.
Похідні фенантренізохіноліну
Більшість лікарських речовин цієї групи відноситься до підгрупи морфінану: морфіну гідрохлорид, кодеїн, етилморфіну гідрохлорид.

Морфіну гідрохлорид (Morphini hydrochloridum)
7,8-Дидегідро-4,5 (x-епокси-1,7-метилморфінан-3(6x-діолу) гідрохлорид, тригідрат
Фізичні властивості
Морфіну гідрохлорид – білі голчасті кристали або білий кристалічний порошок, який жовтіє при зберіганні. Повільно розчинний у воді, важко розчинний у спирті.
Кислотно-основні властивості морфіну пояснюються наявністю третинного нітрогену (центр основності) і фенольного гідроксилу (центр кислотності). Основність морфіну менше виражена, ніж у аміаку, а кислотні – трохи сильніше, ніж у фенолу.
Тотожність
ДФрекомендує для визначення тотожності морфіну гідрохлориду взаємодію його розчину з розчином аміаку – випадає білий осад основи. При подальшому додаванні розчину натрію гідроксиду осад розчиняється (утворюється фенолят).
Як і солі інших алкалоїдів, морфіну гідрохлорид взаємодіє з загальноалкалоїдними осаджувальними реактивами.
Відновні властивості морфіну зумовлені наявністю частково гідрованої системи фенантрену, а також фенольного гідроксилу і вторинної спиртової групи.
Розчини морфіну гідрохлориду дуже легко окиснюються, особливо на світлі і в лужному середовищі. Більша стійкість препарату спостерігається при рН 2,5.
Взаємодія морфіну гідрохлориду і інших препаратів групи морфінану з сильними окиснювачами приводить до утворення різнозабарвлених продуктів окиснення.
Для ідентифікації морфіну гідрохлориду ДФ рекомендує реакцію з реактивом Маркі і з розчином амонію молібдату і концентрованої сульфатної кислоти (реактив Фреде).
При взаємодії морфіну з реактивом Маркі утворюється пурпурове забарвлення, що переходить у фіолетове.
З реактивом Фреде з’являється фіолетове забарвлення, яке переходить в синє.
При взаємодії препарату з реактивом Ердмана (суміш концентрованих H2SO4 і HNO3) утворюється продукт червоного кольору.
 |
Якщо до водного розчину морфіну гідрохлориду додати К3[Fe(CN)6] та FeCI3, то з’являється синій осад або синє забарвлення, зумовлені утворенням берлінської лазурі. Реакція полягає в тому, що калію гексаціаноферат (ІІІ) оксидує морфін в оксидоморфін, а сам відновлюється до калію гексаціаноферату(ІІ), який утворює з феруму (ІІІ) хлоридом “берлінську блакить”:
3K4[Fe(CN)6] + FeCI3 → Fe4[Fe(CN)6]3↓ + 12 KCI
Реакція Пеллагрі полягає в нагріванні морфіну гідрохлориду з сумішшю НСІ та концентрованої H2SO4 до повного видалення НСІ. Залишок розчиняють у воді, нейтралізують содою і додають до утвореного розчину 1-3 краплі спиртового розчину йоду. Якщо утворений зелений розчин збовтати з ефіром, то ефір забарвиться в червоний колір, а водний розчин залишиться зеленим. Ця реакція полягає у відщепленні від молекули морфіну води і утворенні апоморфіну, який дає зазначені реакції:
С17Н19O3N → C17H17O2N + H2O
Кількісне визначення.
Кількісне визначенняморфіну гідрохлориду проводять методом кислотно-основного титрування в середовищі оцтової кислоти в присутності меркурію(П) ацетату.
 |
Кодеїн (Codeinum)






