Тотожність
1. Для встановлення справжності хлоралгідрату ДФ Х рекомендує використовувати загальну на альдегіди реакцію відновлення срібла (“реакцію срібного дзеркала”):
 |
 |
2. Справжність хлоралгідрату можна встановити по утворенню хлороформу під дією натрію гідроксиду (при кімнатній температурі):
Кількісне визначення
 |
Кількісно хлоралгідрат визначають методом кислотно-основного титрування. Наважку препарату розчиняють в надлишку 0,1н. розчину натрію гідроксиду, перемішують і відтитровують 0,1н. розчином хлоридної кислоти, індикатор – фенолфталеїн:
Специфічна домішка
 |
Домішкою в хлоралгідраті може бути проміжний продукт синтезу – трихлорнапівацеталь (хлоралкоголят), який виявляють по утворенню йодоформу в лужному середовищі при дії йодом:
Зберігання
Хлоралгідрат зберігають за списком Б в сухому прохолодному і темному місці, в добре закритій тарі, так як він – гігроскопічний (особливо при підвищеній вологості) і повільно випаровується на повітрі. У водних розчинах і на світлі препарат розкладається з утворенням дихлороцтового альдегіду і трихлороцтової кислоти.
Застосування
Хлоралгідрат в дозах 0,2-0,5 г на прийом здійснює заспокоюючу, а в дозах 0,5-1,0 г снодійну і протисудомну дію.
Питання для самоконтролю
1. Які сполуки називаються альдегідами, які їх основні властивості?
2. Як залежить фармакологічна активність альдегідів від їх будови?
3. Як визначають в розчині формальдегіду домішку мурашиної кислоти?
4. З якою метою до розчину формальдегіду додають метиловий спирт?
5. Як кількісно можна визначити хлоралгідрат?
6. Яке медичне застосування розчину формальдегіду та хлоралгідрату?
Тестові завдання
1. До препаратів альдегідів належить:
А) хлороформ; В) хлоралгідрат;
С) етилхлорид; D) йодоформ.
2. Розчин формальдегіду стабілізують додованням:
А) оцтову кислоту; В) метиловий спирт;
С) хлороформ; D) етанол.
3. Кількісно визначення розчину формальдегіду можна проводити методом:
А) йодометрії; В) комплексонометрії;
С) нітритометрії; D) йодохлорометрії.
4. Домішкою в хлоралгідраті може бути проміжний продукт синтезу – трихлорнапівацеталь (хлоралкоголят), який виявляють за утворенням:
А) хлороформу; В) йодоформу;
С) амоніаку; D) оцтової кислоти.
ЛІКАРСЬКІ РЕЧОВИНИ – ПОХІДНІ КАРБОНОВИХ КИСЛОТ АЛІФАТИЧНОГО РЯДУ
Карбонові кислоти аліфатичного ряду представляють собою похідні вуглеводнів, в яких один атом гідрогену заміщений на карбоксильну групу. Цю групу сполук можна розглядати як кінцевий продукт окислення спиртів, не пов’язаний з порушенням вуглецевого ланцюга:
[O] [O]
R–CH2OH → R–COH → R–COOH
По фізичним властивостям карбонові кислоти – рідини або тверді речовини. Низькомолекулярні карбонові кислоти добре розчиняються у воді.
Хімічні властивості карбонових кислот обумовлені наявністю в молекулі карбоксильної групи. В розчинах органічні кислоти дисоціюють на іони:
R–COOH → R–COO‾ + H+
Вони, як правило, слабкі кислоти. Константи дисоціації більшості органічних кислот знаходяться в межах 1,4∙10‾5 – 1,0∙10‾4, тобто значно нижчі, ніж у неорганічних кислот.
З лугами карбонові кислоти утворюють солі, розчинні у воді. Солі у водних розчинах дисоціюють на іони, які можна виявити різноманітними реактивами. З солями важких металів багато органічних кислот утворюють забарвлені осади.
Однією з характерних властивостей карбонових кислот є здатність вступати зі спиртами в реакції естерифікації, в результаті яких утворюються складні ефіри. За властивостями (смак, запах) вони відрізняються від відповідних кислот. Загальна схема естерифікації:
R–COOH + HOCH2–R1 ↔ R–COOCH2–R1 + H2O
Зворотній процес називається реакцією гідролізу (омилення). Ці хімічні властивості використовуються у фармацевтичному аналізі для ідентифікації і кількісного визначення препаратів карбонових кислот.
Фармакологічна дія, характерна вуглеводням, лише в незначній мірі зберігається у відповідних органічних кислот. Токсичність карбонових кислот в порівнянні з альдегідами різко знижується. Введення карбоксильної групи в молекулу знижує токсичність. Наявність в молекулі розгалуженого аліфатичного радикалу, ненасичених зв’язків, введення галогенів підвищує фармакологічну активність кислот. Однак більшість аліфатичних карбонових кислот фармакологічно малоактивні або відіграють роль поживних речовин, або являються “носіями” фармакологічно активних катіонів (кальцію, феруму). Ряд низькомолекулярних аліфатичних кислот (оцтова та ін.) мають подразнюючу та припікаючу дію. Накопичуючись у крові, органічні кислоти можуть викликати гемоліз. Це обумовлено дисоціацією кислот з утворенням іонів гідрогену.
В медичній практиці використовують калію ацетат, кальцію лактат, кальцію глюконат, натрію лактат для ін’єкцій.
Калію ацетат (Kalii acetas)
СН3СООК
Фізичні властивості
Калію ацетат – білий кристалічний порошок солонуватий на смак, зі слабким запахом оцтової кислоти. Гігроскопічний, на повітрі розпливається. Дуже легкорозчинний у воді, легкорозчинний у спирті.
Добування
Калію ацетат одержують нейтралізацією оцтової кислоти еквівалентною кількістю калію карбонату:
2СН3СООН + К2СО3 → 2СН3СООК + Н2О + СО2↑
Тотожність
Для випробовування справжності калію ацетату з допомогою відповідних аналітичних реакцій виявляють у розчині препарату наявність іонів калію та ацетат-іонів.
4.Реакції на іони К+:
а) забарвлення безбарвного полум’я у фіолетовий колір;
б) з винною кислотою в присутності натрію ацетату і 95% спирту спостерігається утворення білого кристалічного осаду, розчинного у розведених мінеральних кислотах і розчинах лугів:
К+ + Н2С4Н4О6 → КНС4Н4О6↓ + Н+;
в) з натрію гексанітрокобальтатом в оцтовокислому середовищі випадає жовтий кристалічний осад:
2К+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2Na+.
5.Реакції на ацетат-іони СН3СОО–:
а) реакція утворення оцтовоетилового естеру при взаємодії препарату з етиловим спиртом в присутності концентрованої сульфатної кислоти; етилацетат має характерний фруктовий запах:
2СН3СООК + 2С2Н5ОН + Н2SO4 → 2CH3COOC2H5 + K2SO4 + 2H2O
етилацетат
б) ацетат-іон в нейтральних розчинах утворює з феруму (ІІІ) хлоридом сполуки, забарвлені в інтенсивно-червоний або буро-червоний колір:
3FeCl3+9CH3COOK+2H2O→[(CH3COO)6Fe3(OH)2]+CH3COO–+2CH3COOH+ 9KCl.
Кількісне визначення
ДФУ рекомендує для кількісного визначення препарату метод нейтралізації.
1. Ацидиметрія в неводному середовищі: наважку препарату розчиняють в льодяній оцтовій кислоті і титрують 0,1н. розчином хлорної кислоти (індикатор – кристалічний фіолетовий), Е = М.м.:
СН3СООК + СН3СООН → (СН3СООКН)+∙СН3СОО–
НClО4 + СН3СООН → (СН3СООН2)+ ∙ ClО4–
(СН3СООКН)+∙СН3СОО– + (СН3СООН2)+∙ClО4– → КClО4 + 3СН3СООН
____________________________________________________________
СН3СООК + НClО4 → СН3СООН +КClО4
Паралельно проводять контрольний дослід.
2. Ацидиметрія, пряме титрування, індикатор – розчин тропеоліну 00 (рН переходу 1,3-3,2), Е = М.м.:
СН3СООК + НCl → СН3СООН +КCl.
Зберігання
Калію ацетат у зв’язку з його гігроскопічністю зберігають у добре закупореній тарі.
Застосування
Калію ацетат застосовують в якості джерела іонів калію (при гіпо-каліємії) і діуретичного засобу (при набряках, пов’язаних з порушенням кровообігу).
Кальцію лактат (Calcii lactas)
 |  |
СН3–СН–СОО– Са2+∙ 5Н2О
│
ОН 2
Фізичні властивості
Кальцію лактат – білий дрібний порошок без запаху. На повітрі вивітрюється. Повільно розчиняється у воді, легкорозчинний у гарячій воді, малорозчинний у спирті, ефірі та хлороформі.
Добування
Кальцієву сіль молочної кислоти отримують окисленням глюкози в присутності сполук кальцію. Молочна кислота утворюється в результаті бродіння глюкози. Процес протікає під впливом культур молочнокислих бактерій при 35-45˚С. Утворену молочну кислоту нейтралізують, додаючи карбонат кальцію:
С6Н12О6 → 2СН3–СН–СООН
│
ОН

 2СН3–СН–СООН + СаСО3 → СН3–СН–СОО– Са2+ + Н2О + СО2 ↑
2СН3–СН–СООН + СаСО3 → СН3–СН–СОО– Са2+ + Н2О + СО2 ↑
│ │
ОН ОН 2
Тотожність
Для випробовування тотожності кальцію лактату з допомогою відповідних аналітичних реакцій виявляють у розчині препарату наявність іонів кальцію та лактат-іонів.
1. Реакції на іони Са 2+:
а) з розчином амонію оксалату утворюється білий осад кальцію оксалату:
Са2+ + С2О4– → СаС2О4↓
б) забарвлення безбарвного полум’я в цегляно-червоний колір.
2. Реакція на лактат-іони:
Лактат-іон ідентифікують розкладом калію перманганатом в кислому середовищі – утворюється ацетальдегід, який має характерний запах, а розчин перманганату знебарвлюється:


5 СН3–СН–СОО– Са2+ + 4КMnO4 + 11H2SO4 → 10CH3CОН ↑ + 5CaSO4↓ +
│
ОН 2
2K2SO4 + +4MnSO4 + 16H2O + 10CO2↑
Кількісне визначення
 |
Кальцію лактат кількісно визначають комплексонометричним методом; пряме титрування 0,05М розчином трилону Б в присутності аміачного буфера до зміни забарвлення від червоного до синьо-фіолетового, індикатор – кислотний хром темно-синій, Е = М.м.:
Зберігання
Кальцію лактат зберігають у добре закупореній тарі, через можливість втрати препаратом кристалізаційної води.
Застосування
Кальцію лактат використовують як джерело іонів кальцію і в якості антиалергенного засобу. По фармакологічній дії він схожий до кальцію хлориду, але здійснює менш подразнюючу дію на слизову оболонку шлунка.
Кальцію глюконат (Calcii gluconas)

Н Н ОН Н
| | | |
НО―СН2―С―С―С―С―СОО Са2+ ∙ Н2О
| | | |
ОН ОН Н ОН 2
Фізичні властивості
Кальцію глюконат – білий зернистий або кристалічний порошок без запаху і смаку. Повільно розчинний у 50 частинах води, розчинний у 5 частинах киплячої води, практично нерозчинний у спирті та ефірі.
Добування
Кальцію глюконат добувають електрохімічним окисленням глюкози в присутності броміду кальцію та карбонату кальцію:
 СOH СOOH COO‾
СOH СOOH COO‾
| Br2; H2O | CaCO3 |
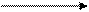
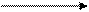 (СНОН)4 (СНОН)4 (СНОН)4 Ca2+
(СНОН)4 (СНОН)4 (СНОН)4 Ca2+
| -2HBr | -CO2 |
СН2ОН СН2ОН СН2ОН 2
глюкоза
Тотожність
1. Реакції на іони Са2+:
а) з розчином амонію оксалату утворюється білий осад кальцію оксалату:
Са2+ + С2О4– → СаС2О4↓
б) забарвлення безбарвного полум’я в цегляно-червоний колір.
2. Реакція на глюконат-іон:
З розчином феруму(ІІІ) хлориду з’являється ясно-зелене забарвлення розчину.
Специфічні домішки декстрину і сахарози відкривають реактивом Фелінга після їх кислотного гідролізу до глюкози – не повинен утворюватися червоний осад.
Кількісне визначення
Кальцію глюконат кількісно визначають комплексонометричним методом; пряме титрування 0,05М розчином трилону Б в присутності амоніачного буфера до зміни забарвлення від червоного до синьо-фіолетового, індикатор – кислотний хром темно-синій, Е = М.м.
Зберігання
Кальцію глюконат зберігають у добре закупореній тарі, через можливість втрати препаратом кристалізаційної води.
Застосування
Кальцію глюконат використовують як джерело іонів кальцію і в якості антиалергенного та кровоспинного засобу. По фармакологічній дії він схожий до кальцію хлориду, але здійснює менш подразнюючу дію на слизову оболонку шлунка.
Натрію цитрат (Natrii citras)
H2C―COONa
|
HO―C―COONa ∙ 5½ H2O
|
H2C―COONa
Фізичні властивості
Натрію цитрат – безбарвні кристали або білий кристалічний порошок солонуватого смаку, без запаху, вивітрюється на повітрі. Препарат добре розчинний у воді, практично нерозчинний у спирті.
Добування
Натрію цитрат одержують взаємодією цитринової кислоти з натрію карбонатом:
H2C―COOH H2C―COONa
| |
2 HO―C―COOH + Na2CO3 → 2 HO―C―COONa + 3H2O + 3CO2↑
| |
H2C―COOH H2C―COONa
Тотожність
Для випробовування тотожності натрію цитрату з допомогою відповідних аналітичних реакцій виявляють у розчині препарату наявність іонів натрію та цитрат-іонів.
1. Реакції на іони Na+:
а) з розчином цинк-уранілацетатом в оцтовокислому середовищі утворю-ється жовтий кристалічний осад:
Na++Zn2++[(UO2)3(CH3COO)8]2‾+CH3COO‾+9H2O→NaZn[(UO2)3(CH3COO)9]∙ 9H2O↓
б) забарвлює безбарвне полум’я в жовтий колір.
2. Реакції на цитрат-іони:
а) з розчином кальцію хлориду при кип’ятінні утворюється білий осад кальцію цитрату:
 H2C―COONa H2C―COO‾
H2C―COONa H2C―COO‾
| t˚ |
2 HO―C―COONa + 3СаCl2 → HO―C―COO‾ Ca3↓ + 6NaCl
| |
H2C―COONa H2C―COO‾ 2
б) реакція утворення пентабромацетону при взаємодії з розчином калію перманганату і бромною водою; випадає білий кристалічний осад (нефармакопейна реакція):
H2C―COONa H2C―COOН CH3 CBr3

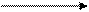

 | Н+ | KMnO4; t˚ | 5Br2 | HO―C―COONa HO―C―COOН C = O C = O
| Н+ | KMnO4; t˚ | 5Br2 | HO―C―COONa HO―C―COOН C = O C = O
| | -3CO2,-H+ | -5HBr |
H2C―COONa H2C―COOН CH3 CHBr2
ацетон
Специфічна домішка
Солі щавелевої кислоти відкривають дією розчином кальцію хлориду – розчин має залишитися прозорим:
С2О4– + Са2+ → СаС2О4↓
Повинен містити не більше 0,03% домішок солей кальцію.
Кількісне визначення
1. Іонообмінна хроматографія, яку поєднують з методом нейтралізації. Наважку препарату розчиняють і пропускають через колонку з катіонітом КУ-2 в Н-формі. Відбувається обмін іонів:
H2C―COONa H2C―COOH
| |
 3 [Kat]ˉH+ + HO―C―COONa HO―C―COOH + 3[Kat]ˉ Na+
3 [Kat]ˉH+ + HO―C―COONa HO―C―COOH + 3[Kat]ˉ Na+
| |
H2C―COONa H2C―COOH
Цитринову кислоту, яка утворилася, нейтралізують 0,05н. розчином натрію гідроксиду, індикатор – метиловий оранжевий, Е = 1/3М.м.:
H2C―COOH H2C―COONa
| |
 HO―C―COOH + 3NaOH HO―C―COONa + 3H2O
HO―C―COOH + 3NaOH HO―C―COONa + 3H2O
| |
H2C―COOH H2C―COONa
2. Аргентометрія за методом Фольгарда, Е = 1/3 М.м. – грунтується на осадженні цитрат-іонів надлишком стандартного розчину аргентуму нітрату з подальшим його відтитровуванням стандартним розчином амонію роданіду:
 H2C―COONa H2C―COOAg
H2C―COONa H2C―COOAg
| |
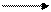 HO―C―COONa + 3 AgNO3 HO―C―COOAg + 3NaNO3
HO―C―COONa + 3 AgNO3 HO―C―COOAg + 3NaNO3
| |
H2C―COONa H2C―COOAg
 AgNO3 + NH4SCN AgSCN↓ + NH4NO3
AgNO3 + NH4SCN AgSCN↓ + NH4NO3
 FeNH4(SO4)2 + 3NH4SCN Fe(SCN)3 + 2(NH4)2SO4
FeNH4(SO4)2 + 3NH4SCN Fe(SCN)3 + 2(NH4)2SO4
Зберігання
Натрію цитрат зберігають у добре закупореній тарі через можливість втрати препаратом кристалізаційної води.
Застосування
Натрію цитрат застосовують для консервації крові у вигляді 4-5%-вого розчину – запобігає зсіданню і створює лужний резерв крові.
Питання для самоконтролю
1. Які сполуки називаються карбоновими кислотами, які їх основні властивості?
2. Як залежить фармакологічна активність карбонових кислот від їх будови?
3. Чому калію ацетат рекомендується зберігати у добре закупореній тарі?
4. Яким методом можна кількісно визначити кальцію лактат?
5. Який препарат використовують для консервації крові?
6. За допомогою яких аналітичних реакцій можна довести наявність цитрат- іонів у розчині препарату цитрату натрію?
Тестові завдання
1. Кількісне визначення калію ацетату можна проводити методами:
А) ацидиметрії; В) йодометрії;
С) йодохлорометрії; D) нітритометрії.
2. Комплексонометричним методом кількісно можна визначити лікарські речовини:
кальцію глюконат; B) кислоту аскорбінову;
C) натрію нітрит; D) калію йодид.
3. Яким методом можна ідентифікувати калію ацетат:
забарвленням полум’я у фіолетовий колір;
реакцією з гексанітритокобальтатом натрію;
реакцією з хлоридом феруму (ІІІ);
всіма вказаними методами.
4. Глюконат кальцію визначають комплексонометрично, при цьому робочим розчином є:
А)розчин хлоридної кислоти; В) розчин натрію гідроксиду;
С) розчин трилону Б; D)розчин калію йодиду.
ЛІКАРСЬКІ РЕЧОВИНИ – АМІНОКИСЛОТИ АЛІФАТИЧНОГО РЯДУ
 |
Амінокислоти є похідними карбонових кислот, що містять в молекулі одну або декілька аміногруп. α-Амінокислоти є структурними елементами білків і широко поширені в природі. З білкових гідролізатів отримано 20 α-амінокислот загальної формули:
Природні амінокислоти можна одержати гідролізом білків в середовищі соляної або сірчаної кислот при нагріванні. Джерелом білків служать м’ясо, шкіра, желатин, шерсть, волос, перо, казеїн із творога та ін.
Важливе значення мають синтетичні способи одержання амінокислот і особливо їх аналогів. Вихідними продуктами синтезу можуть служити α-галогензаміщені карбонові кислоти, аміномалоновий ефір, оксопохідні ароматичних і гетероциклічних сполук, оксими, гідразони. Використовують також способи перетворення однієї амінокислоти в іншу або одержання з амінокислот різних синтетичних похідних.
 |
Амінокислоти аліфатичного ряду – це білі кристалічні речовини, як правило, розчинні у воді і нерозчинні в органічних розчинниках. Через наявність в молекулі кислотної (карбоксильної) і основної (аміно) груп вони існують у водних розчинах у вигляді біполярних іонів:
Присутність в молекулі карбоксильної і аміногруп обумовлює хімічні властивості амінокислот. Вони вступають в реакції етерифікації (по карбоксильній групі), алкілування і ацилювання(по аміногрупі), можуть відновлюватися, декарбоксилюватися, утворювати пептиди і т.д.
 |
Для ідентифікації амінокислот використовують їх здатність до утворення внутрішньокомплексних сполук з різними катіонами (аргентуму, купруму, меркурію, плюмбуму, цинку, кобальту та ін.). Найбільш характерна для амінокислот реакція з катіоном купруму (ІІ), який утворює комплексну сполуку темно-синього кольору:
Для виявлення амінокислот застосовують і високочутливу нінгідринову реакцію. Вона протікає при одночасній участі аміно- і карбоксильної груп. Всі α-амінокислоти утворюють синьо-фіолетове забарвлення при нагріванні з нінгідрином:

Будучи амфолітами (амфотерними сполуками), амінокислоти утворюють солі як з кислотами, так і з лугами:

Застосування амінокислот в медичній практиці грунтується на їх здатності брати участь в азотистому обміні; в синтезі необхідних для нормальної функції організму білків, пептидів, ферментів, гормонів; в утворенні кінцевих продуктів азотистого обміну: аміаку, сечовини та інших життєво важливих процесах.
Як ліки найчастіше застосовуються амінокислоти та їх синтетичні аналоги: кислота глутамінова, цистеїн, метіонін.
 |
Кислота глутамінова (Acidum glutamicum)
α-Аміноглутарова кислота
Фізичні властивості
Кислота глутамінова – білий кристалічний порошок кислого смаку, з ледь відчутним запахом. Температура плавлення не нижче 190ºС. Питоме обертання від +30 до +34º (5%-ний розчин в розбавленій соляній кислоті). Порошок легко розчинний у киплячій воді, мало розчинний у холодній воді, практично нерозчинний у оцтовій кислоті, ацетоні, 96% спирті і ефірі.
Добування
Кислоту глутамінову одержують гідролізом білкових речовин або синтетично. В міозині, казеїні, α-лактоглобуліні міститься до 20% глутамінової кислоти. Вихідним продуктом синтезу кислоти глутамінової служить аміномалоновий ефір. Для одержання кислоти глутамінової його ацетилюють, конденсують з акрилонітрилом, а потім гідролізують і декарбоксилюють:
 |
Тотожність
1. За фізичними константами: температура плавлення, питоме обертання; фізико-хімічними методами: ІЧ-спектроскопія та тонкошарова хроматографія.
 |
2. Реакція з натрію гідроксидом в присутності фенолфталеїну – виникає червоне забарвлення, яке зникає при додаванні розчину формальдегіду. Якщо до одержаного розчину додати розчин натрію гідроксиду, знову з’являється червоне забарвлення:
3. Нефармакопейна реакція з CuSO4 – у лужному середовищі утворюється комплексна сіль, забарвлена у темно-синій колір.
Кількісне визначення
 |
1. Алкаліметрія, пряме титрування; титрують 0,1 н. розчином гідроксиду натрію з індикатором бром тимоловим синім (рН переходу 6,0-7,6):
2. Метод Кьєльдаля – метод, заснований на визначенні азоту в органічних сполуках після мінералізації препарату кислотою сульфатною.
Зберігання
Препарат зберігають у добре закупореній тарі, яка захищає від дії світла.
Застосування
Кислоту глутамінову застосовують для лікування шизофренії, епілепсії та інших психічних і нервових захворювань. Аналогічно застосовують магнієву або кальцієву солі глутамінової кислоти.






