4,5α-Епокси-3-метокси-17-метил-7,8-дидегідроморфінан-6α-ол
Фізичні властивості
Кодеїн – білий кристалічний порошок без запаху. Легко розчинний у воді, мало в спирті.
Опіоїдний анальгетик.
Вміст кодеїну в опії невеликий, тому його одержують напівсинтетичним шляхом – метилюванням морфіну.
Тотожність
Структурна схожість кодеїну з морфіном зумовлює те, що препарати реагують з однаковими окиснювачами. Але різне забарвлення продуктів реакцій дозволяє їх розрізнити
1. Реакція кодеїну з реактивом Маркі приводить до утворення синьо-фіолетового забарвлення, яке посилюється при стоянні. З концентрованою H2SO4 в присутності феруму (ІІІ) хлориду, як каталізатора, утворюється продукт синього кольору, який після додавання невеликої кількості розведеної нітратної кислоти змінюється на червоний.
2. Після додавання до кодеїну концентрованої нітратної кислоти виникає оранжеве забарвлення, яке переходить в жовте.
3. З реактивом Фреде кодеїн реагує з утворенням продукту фіолетового забарвлення, а з реактивом Ердмана – червоного. Кількісне визначення кодеїну – ацидиметрія. Кодеїн відрізняється від багатьох алкалоїдів і синтетичних основ не тільки розчинністю у воді,але і силою основності.
Кількісне визначення
1. рН водного розчину знаходиться в межах 9,0. Це дозволяє визначати кількісно кодеїн методом кислотно-основного титрування у водному середовищі. Титрант – 0,1 М розчин хлоридної кислоти, індикатор – метиловий червоний.
2. Кодеїну фосфат визначають кількісно методом кислотно-основного титрування в неводному середовищі (розчинник – кислота оцтова льодяна, титрант – 0,1 М розчин кислоти хлорної)..

Етилморфіну гідрохлорид
Етилморфіну гідрохлорид – білий кристалічний порошок, гіркий на смак. Розчиняється у воді (1:12), слабко розчиняється в спирті, майже нерозчинний в ефірі та хлороформі. Аналізується за тих же умов, що і морфіну гідрохлорид та кодеїн. При взаємодії препарату з концентрованою сульфатною кислотою в присутності FeCI3 як каталізатора, виникає зелене забарвлення, яке переходить в фіолетово-синє, а при додаванні 1 краплини нітратної кислоти розведеної – в червоне.
Застосовують для заспокоєння кашлю при хронічних бронхітах та туберкульозі легенів, як болезаспокійливий засіб в очній практиці.
Похідні імідазолу: пілокарпіну гідрохлорид, дибазол, метронідазол, клонідину гідрохлорид

Пілокарпіну гідрохлорид
(3S,4R)-3-Етил-4-[1-метил-1Н-імідазол-5-іл)метил]дигідро-3Н-фуран-
2-она гідрохлорид)
Пілокарпіну гідрохлорид – безбарвні кристали або білий кристалічний порошок. Гігроскопічний. Дуже легко розчинний у воді, легко розчинний в спирті, практично нерозчинний в ефірі і хлороформі.
Молекула включає два цикла: імідазолу і 4,5-дигідрофуранону (лактону), в якого у 3-му і 4-му положенні є два центри хіральності. Пілокарпін – сполука природного походження, алкалоїд. Застосовують як міотичний засіб для звуження зіниць при лікуванні глаукоми, а також при тромбозі центральної вени сітківки, атрофії зорового нерва. Бендазолу гідрохлорид (дибазол), метронідазол і клонідину гідрохлорид (клофелін) – препарат синтетичного походження. Застосовують як холіноміметичний засіб (міотичний) засіб, дибазол – як спазмолітичний і гіпотензивний, клонідіну гідрохлорид – гіпотензивний, метронідазол – протимікробний і протипаразитичний засіб.
Фізико-хімічні властивості. За зовнішнім виглядом ЛЗ є білими кристалічними порошками, для метронідазолу допускається зеленкуватий відтінок. Дибазол і метронідазол – малорозчинні у воді, пілокарпіну хлорид і клонідину гідрохлорид легко розчинні у воді.
Всі лікарські засоби цієї групи мають характерні спектри поглинання в ІЧ- і УФ областях спектра. Пілокарпіну гідрохлорид, як оптично активна сполука, характеризується величиною питомого обертання.
Кислотно-основні властивості. Похідні імідазолу – слабкі однокислотні основи. Їх солі з хлоридною кислотою піддаються гідролізу з утворенням кислого середовища розчину. Тому при оцінці якості ЛЗ нормується кислотність препарату.
За рахунок основних властивостей ЛЗ даної групи утворюють з загальноалкалоїдними реактивами нерозчинні комплексні солі.
Гідролітичний розклад характерний для пілокарпіну гідрохлориду за рахунок наявності лактонного циклу. В лужному середовищі цикл розкривається і одночасно відбувається ізомеризація речовини, що призводить до втрати активності. За рахунок лактонного циклу пілокарпін дає гідроксамову пробу.
Специфічні реакції. 1. Пілокарпіну гідрохлорид вступає в реакцію, яка називається пробою Хелча. Суть її полягає в утворенні комплексної солі основи пілокарпіну з хромпероксидом CrO5. До розчину пілокарпіну гідрохлориду додають реактиви: кислоту сульфатну, калію дихромат, гідрогену пероксид і хлороформ. При цьому утворюються надхромові кислоти і хромпероксид, який з основою пілокарпіну утворює забарвлену в синьо-фіолетовий колір комплексну сіль, що переходить у хлороформний шар.
2. При додаванні до водного рорзчину препарату нітратної кислоти та аргентуму нітрату утворюється білий осад аргентуму хлориду.
3. Препарат, розтертий з каломеллю, стає чорним внаслідок утворення металічної ртуті при оксидації пілокарпіну.
Кількісне визначення
1. Титрування препарату в льодяній оцтовій кислоті (або мурашиній) 0,1 М розчином НСІО4 при наявності меркурію (ІІ) ацетату та індикатора – кристалічного фіолетового.
2. Використовують алкаліметрію (при внутрішньоаптечному контролі). Титрують лугом за залишком хлоридної кислоти в присутності хлороформу, який екстрагує органічну основу.
Похідні пурину
В основі цієї групи алкалоїдів лежить ядро пурину, яке складається з двох конденсованих кілець: піримідинового і імідазольного. Медичне застосування пуринових алкалоїдів грунтується на їх стимулюючій дії на центральну нервову систему і серце.Сполуки групи пурину містяться в рослинах і тканинах тварин у вільному стані, а також входять до складу нуклеозидів, нуклеотидів і нуклеїнових кислот. Нуклеїнові кислоти присутні у клітинах всіх живих організмів і виконують важливі функції – зберігання і передачі генетичної інформації. До похідних пурину відноситься велика група лікарських речовин, які проявляють різну фармакологічну активність – бронхолітичну, діуретичну, кардіотонічну, протипухлинну дію на ЦНС.
ЛЗ – похідні пурину – за хімічною будовою діляться на групи: похідні ксантину, нуклеозиди і нуклеотиди пуріну, синтетичні похідні пурину.
Похідні ксантину: кофеїн, кофеїн-бензоат натрію, теобромін, теофілін, еуфілін, темісал.
Нуклеотиди і нуклеозиди: рибоксин, АТФ.
Синтетичні похідні пурину: меркаптопурин, азатіоприн, етимізол, алопуринол
Фізичні властивості. Всі сполуки групи пурину – кристалічні порошки білого кольору.

Кофеїн (Coffeinum)
1,3,7- Триметилксантин
Фізичні властивості
Кофеїн – білі шовковисті голчасті кристали або білий кристалічний порошок. На повітрі вивітрюється, при нагріванні сублімується. Повільно розчиняється у воді (1:60), легко розчинний в гарячій воді і хлороформі, важко розчинний у спирті. Кофеїн-бензоат натрію – комплексна сіль кофеїну з бензоатом натрію з вмістом кофеїну 40%. Білий порошок без запаху, легко розчинний у воді, важко – у спирті.
 |
Теобромін (Theobrominum)
3,7-Диметилксантин
Фізичні властивості
Теобромін – білий кристалічний порошок без запаху, дуже мало розчинний у воді, мало розчинний у спирті, ефірі, хлорофоормі, легко розчинний в розведених кислотах і лугах.
 |
Теофілін (Theophyllinum)
1,3- Диметилксантин
Фізичні властивості
Теофілін – білий кристалічний порошок без запаху, мало розчинний у воді, спирті і хлороформі. Легко розчинний в гарячій воді і гарячому спирті, розчинний в розчинах кислот і лугів.
Темісал – подвійна сіль натрію теоброміну з натрію саліцилатом – білий порошок, розчинний у воді. Водні розчини мають лужну реакцію, розкладаються при взаємодії з мінеральними і органічними кислотами, вуглекислим газом та карбонатами.
 |
Еуфілін – сіль теофіліна з етилендіаміном.
Білий або білий з жовтуватим відтінком кристалічний порошок з слабким аміачним запахом, поглинає вуглекислоту з повітря, при цьому розчинність зменшується.
Лікарські речовини групи пурину – слабкі основи, які утворюють з кислотами нестійкі солі при протонуванні нітрогену в 9-му положенні. Теобромін і теофілін є амфотерними сполуками. Їх основні властивості зумовлені наявністю неподіленої пари електронів атому нітрогену в 9-му положенні. Кислотні властивості теоброміну зв’язані з рухливістю атома нітрогену імідної групи, а теофіліну – з рухливістю атома гідрогену в 7-му положенні.
Тотожність
1. Загальногрупова реакція – мурексидна проба, грунтується на окисно-гідролітичному розкладі речовин групи ксантину до похідних піримідину, в яких одна або дві аміногрупи конденсуються між собою з утворенням пурпурної кислоти, яка у вигляді амонійної солі має червоно-фіолетове забарвлення. Препарат нагрівають на водяному огрівнику до повного випаровування з окисником (Н2О2, Вr2, HNO3) в кислому середовищі. Потім додають розчин аміаку; з’являється пурпурово-червоне забарвлення.
2. Кофеїн осаджується з розчинів таніном, сулемою, реактивом Драгендорфа.
3. Теобромін з аміачним розчином аргентуму нітрату утворює срібну сіль теоброміну. З реактивом Вагнера випадає бурий осад С7Н8О2N4∙I4∙HI, а з кобальту хлоридом – сіро-блакитний осад.
Кількісне визначення
Кількісно визначають препарати:
1) титруванням у неводному середовищі; розчинник – льодяна оцтова кислота або суміш льодяної оцтової і мурашиної кислот, титрант – 0,1 М розчин НСІО4. Препарати теофілін і теобромін, які мають кислотні центри, розчиняють в диметилформаміді або піридині і титрують розчинами метилатів натрію або калію;
2) кислотно-основним титруванням у водному середовищі. Натрію кофеїн-бензоат визначають за залишком натрію бензоату, титруючи його хлоридною кислотою в присутності ефіру.
3) методом аргентометрії (зворотне титрування)
4) методом йодометрії; застосовується для визначення кофеїну в натрію кофеїні-бензоаті.
5) методом К’єльдаля.
Питання для самоконтролю
1. Які реакції використовуються при аналізі ЛЗ нітрофуранового ряду, що грунтуються на кислотно-основних властивостях сполук?
2. Охарактеризуйте кислотно-основні властивості ЛЗ похідних піразолу.
3. Назвіть групові реагенти на лікарські засоби групи піразолу. Як з їх допомогою можна ідентифікувати ЛЗ?
4. Які реакції лежать в основі кількісного визначення препаратів імідазолу?
5. Яка реакція є специфічною при ідентифікації пілокарпін гідрохлориду?
6. З якою метою додається меркурію ацетат при кількісному визначенні морфіну гідрохлориду?
7. В чому суть талейохінної проби?
Тестові завдання
1. З перечислених лікарських речовин до азотовмісних відносяться:
А)фурацилін; В)норсульфазол; С) кофеїн; D) кислота аскорбінова.
2. Серед препаратів з групи алкалоїдів пурину амфотерні властивості проявляють:
А) кофеїн; B) теобромін С) ксантин; D) пурин
3. Які з наведених лікарських речовин розчинні у воді?
А) атропіну сульфат; В) теофілін; С) меркаптопурин; D) кодеїн.
4. Ядро пурину включає гетероцикли:
А) піридину; B) піримідину; С) піразолу; D) імідазолу.
5. Кофеїн не утворює осаду з:
А) реактивом Люголя; В) кислотою кремній-вольфрамовою;
С) реактивом Драгендорфа; D) реактивом Маркі.
6. Загальногрупова реакція на похідні пурину – мурексидна проба – грунтується на хімічних процесах:
А) гідролітичного розщеплення; В) електрофільного заміщення; С)окиснення D) нуклеофільного приєднання.
7. Теофілін можна відрізнити від кофеїну реакціями з:
А) розчином аміаку; В) розчином натрію гідроксиду; С) розчином аргентуму нітрату; D) розчином кобальту хлориду.
ЛІКАРСЬКІ РЕЧОВИНИ – ВІТАМІНИ
Вітаміни – складні, біологічно активні органічні сполуки різноманітної хімічної природи, які надходять в невеликих кількостях з їжею в організм тварин і людини, де відіграють велику роль в обміні речовин, беручи участь в процесах біокаталізу. Відсутність або нестача вітамінів в організмі викликає тяжкі захворювання – цингу, рахіт, пелагру, курячу сліпоту і ін. При нестачі вітамінів в організмі розвиваються хвороби, які називають гіповітамінозами. Надлишок вітамінів в організмі приводить до захворювання – гіпервітамінозу. Захворювання, пов’язані з відсутністю вітамінів, називаються авітамінозами.
Речовини, які здатні перетворюватися в організмі людини у вітаміни, називаються провітамінами (наприклад, каротин). Крім вітамінів, існують також їх антагоністи, Це речовини, які або перетворюють вітаміни в недіючі сполуки, або витісняють їх з організму, або блокують ферментатитвні системи, до складу яких входять вітаміни.
Вітаміни поділяють на водорозчинні та жиророзчинні. Наприклад, розчинність рибофлавіну у воді 0,012%, але він належить до водорозчинних, оскільки в рослинних оліях,жирах і ефірах його розчинність ще менша.
До жиророзчинних вітамінів належать вітаміни групи А, Д, Е, F i K, до водорозчинних- вітаміни групи В,С і деякі синтетичні вітаміни групи К.
За хімічною класифікацією вітаміни ділять на такі групи:
1. Вітаміни аліфатичного ряду:
а) ненасичені аліфатичні (вітамін F);
б) похідні лактонів ненасичених поліоксікарбонових кислот (аскорбінова кислота);
в) аміноспирти (холін);
г) пангамові кислоти (вітамін В15);
д) похідні β-амінокислот (пантотенова кислота – вітамін В3).
2. Вітаміни аліциклічного ряду:
а) циклогексанолові вітаміни (ІНОЗИТ);
б) циклогексенові з полієновим ланцюгом ізопреноїдного характеру (ретиноли – вітаміни групи А);
в) циклогексенол-етиленгідринданові (кальцифероли – вітаміни групи D);
3. Вітаміни ароматичного ряду:
а) амінозаміщені ароматичні кислоти (п-амінобензойна кислота – вітамін Н);
б) похідні нафтохінонів (вітаміни групи К),
4. Вітаміни гетероциклічного ряду: (вітаміни групи Е, біофлавоноїди –вітаміни групи Р, вітаміни групи В: В6, В1,Вс, В2, В12).
Кислота аскорбінова γ-лактон-2,3 –дегідро – L – гулонової кислоти:

Кислота аскорбінова, можливо, має генетичну спорідненість з моносахаридами, що проявляється в подібності стуктурних фрагментів. Тому вітамін С міститься в багатьох рослинах.
Кислота аскорбінова – білий кристалічний порошок без запаху, кисла на смак, добре розчинна у воді, розчинна в спирті, практично нерозчинна в ефірі, бензолі, хлороформі.
Аскорбінова кислота має 2 асиметричних атоми вуглецю, оптично активна. ДФ вимагає визначати кут повертання (α) 2% розчину і розраховувати питоме обертання.
Хімічна структура вітаміну С була встановлена у 1933 р. і в цьому ж році був здійснений її синтез.
Кислотні властивості. Енольні гідроксили в 2 і 3 положеннях лактонового кільця мають кислотні властивості, дають кислу реакцію на лакмус, реагують з NaOH i NaНCO3.
На наявності кислотних властивостей грунтується реакція з феруму (П) сульфатом. Утворюється феруму аскорбат:
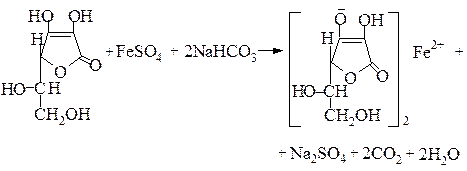
Лактонне кільце аскорбінової кислоти руйнується під дією лугів, потім утворюється фурфурол, виділяється СО2 і вода.
2. Аскорбінова кислота має сильні відновні властивості. Окислювачі ( AgNO3, KMnO4, FeCI3, реактив Фелінга) окиснюють кислоту аскорбінову до кислоти дікетоаскорбінової.
 |
Для визначення тотожності препарату використовують реакцію з аміачним розчином аргентуму нітрату; випадає темний осад металічного срібла:
В реакції аскорбінової кислоти з розчином 2,6 – дихлорфеноліндофеноляту синього кольору забарвлення зникає:

Акорбінова кислота обезбарвлює метиленовий синій, відновлює [Fe(CN)6]3- до [Fe(CN)6]4-, солі Fe3+ до Fe2+, Cu2+ до Cu+.
Кількісне визначення. 1. Алкаліметрія, титрант 0,1 М розчин натрію гідроксиду (титрується як одноосновна кислота по ОН групі в 3-му положенні лактонового кільця; індикатор – фенолфталеїн:

Виражені відновні властивості аскорбінової кислоти лежать в основі декількох методів кількісного визначення вітаміну С(йодометрія, йодатометрія, йодохлорметрія).
2. Йодометрія – титрант розчин йоду в нейтральному, слабкокислому або слабколужному середовищі (пряме титрування):
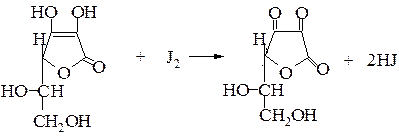
Аскорбінова кислота бере участь в окисно-відновних процесах, що відбуваються в організмі, у вуглекислому бміні, регенерації тканин, утворенні стероїдних гормонів. Денна потреба складає 50-100 мг. Кислота аскорбінова використовується у вигляді порошків, таблеток, розчинів для ін’єкцій. Оскільки в розчинах вона легко окиснюється, розчини для ін’єкцій готують на воді, насиченій СО2 з додаванням стабілізаторів – антиоксидантів (Na2SO4, Na2S2O3). В розчин для ін’єкцій додають натрію гідрокарбонат, тому що препарат має кислу реакцію середовища, яка подразнює тканини.
Застосовується при скорбуті(цинга), гемофілії, кровотечах (з носа. легень, нирок), захворюваннях печінки, променевій хворобі, переломах кісток тощо.
Зберігають у добре закритій тарі з темного скла.
Кальцію пангамат (вітамін В15)

Пангамова кислота – це ефір D-глюконової кислоти і диметиламіноглікоколю. Виділена з рисових висівок, дріждів, крові, печінки. Активує перенесення кисню в клітинах тканин і бере участь в метилюванні біосубстратів.
Представляє собою білий, іноді з жовтуватим відтінком порошок з характерним запахом, гігроскопічний, легко розчинний у воді, практично нерозчинний в органічних розчинниках.
Тотожність визначають: а) реакцією на Са2+
б) Залишок глюконової кислоти з катіоном Fe3+ дає сполуку світло-зеленого забарвлення.
b) При дії на препарат лугу відчувається запах аміаку.
Вітаміни групи В6. Впливають н6а тканинний обмін – нікотинова кислота, її амід(вітамін РР) та оксиметил піридинові вітаміни (група В6).
Вітамін В 1 (тіамін, антиневритний вітамін)
За хімічною будовою його молекула складається з двох гетероциклічних ядер – піримідинового та тіазольного:

Маючи первинну спиртову групу, він може легко реагувати з АТФ, утворюючи тіаміндифосфат (ТДФ + АМФ). Це дозволяє йому виконувати роль коферменту. Він бере участь у вуглеводному обміні. Коферментна функція ТДФ:
окиснювальне декарбоксилювання пірувату та 2-оксоглутарату;
транс-кетолазні реакції пентафосфатного шляху окиснення глюкозо-6-фосфату.
Добова потреба у вітаміні В1 складає 1,5 – 2 мг.
Тіамінна недостатність призводить до:
накопичення в крові та внутрішніх органах і тканинах надлишкового(неокисленого) пірувату;
порушення енергетичного обміну;
виникнення поліневритів („бері-бері”).
Джерела: хліб(переважно житній з борошна грубого помолу, крупи – гречана. вівсяна, пивні дріжді).
Тіаміну хлорид – білий кристалічний порошок, легкорозчинний у воді з утворенням кислих розчинів (рН розчину 2,5 – 3,4), у спирті важкорозчинний, а в ефірі, хлороформі та жирах не розчиняється.
Тотожність
1. Препарат з діазотованою сульфаніловою кислотою дає позитивну реакцію Паулі (рожеве забарвлення), яку використовують для кількісного визначення тіаміну.
2. Тіаміну бромід окиснюється калію фериціанідом в лужному середовищі з утворенням тіохрому, який екстрагують ізоаміловим аба бутиловим спиртом,- спиртовий шар дає блакитну флуоресценцібю в УФ-світлі.
Кількісне визначення. 1. Гравіметрія. 2. Алкаліметрія, пряме титрування, індикатор – бромфеноловий синій або фенолфталеїн. 3. Методи осадження галогену броміду). 4. Для тіаміну хлориду використовують ацидиметрію в неводному середовищі, в присутності меркурію ацетату, індикатор – кристалічний фіолетовий.
Зберігають у герметично закритій тарі, що вберігає від дії світла. Не допускають контакту з металами, щоб запобігти відновленню до дигідротіаміну.
Вітамін В2 (рибофлавін). За хімічною структурою він є похідним трициклічної сполуки ізоалоксазину та спирту рибітолу:

Він, подібно до тіаміну, може за рахунок АТФ фосфорилюватися за первинною спиртовою групою з утворенням ФМН(флавінмононуклеотиду) та ФАД флавінаденіндинуклеотиду).
ФМН і ФАД є коферментами, що беруть участь в окисно-відновних реакціях вуглеводного, ліпідного та амінокислотного обміну; в підтримці нормальної здорової функції очей, в синтезі гемоглобіну. Добова потреба у рибофлавіні складає 2 – 2,5 мг.
Рибофлавінова недостатність зустрічається при загальній недостатності вітамінів.Симптоми В2 –дефіциту проявляються дерматитами, себореєю, кератитами, алопеціями. Джерела: молоко, яйця, печінка, зелені овочі.
Тотожність
1. За рахунок імідної групи рибофлавін взаємодіє з розчином аргентуму нітрату з утворенням оранжево-червоного забарвлення.
2. При додаванні до рибофлавіну концентрованої сульфатної кислоти з’являється червоне забарвлення, яке переходить у жовте при додаванні води.
3. Визначають питоме обертання (0,5 % розчин у водно-спиртовому розчині КОН має питоме обертання від -110 до -130˚ С.
Кількісне визначення проводять одним з приведених нижче методів:
1. Спектрофометрією. 2. Фотометрією. 3, Алкаліметрія після окиснення препарату калію перйодатом.
Зберігають у банках з темного скла.
Вітамін РР (Вітамін В5; ніацин; антипелагричний вітамін)
В організмі вони є взаємно перетворюваними формами. Він входить до складу коферментів НАД+ та НАДФ (містить залишок фосфорної кислоти в 2′ положенні рибози).
Вітамін РР є необхідним фактором в окисно-відновних процесах, пов’язаних з окисненням субстратів вуглеводневого, ліпідного та амінокислотного обміну. Добова потреба у нікотинаміді 18 мг, або 60 мг триптофану (вітамін синтезується в організмі з надлишкового триптофану. Недостатність вітаміну РР проявляється пелагрою: ураження шкіри, слизьової оболонки ротової порожнини, шлунково-кишкового тракту, центральної нервової системи.
Симптоми пелагри проявляються трьома „Д”: дерматитами, діареєю, деменцією(розумове відставання).
Джерела: хліб, рис, гречка, картопля, м’ясо, печінка, риба, молоко, морква та інші продукти
Ідентифікацію препаратів проводять реакцією на піридиновий цикл з 2,4 динітрохлорбензолом та роданбромідним реактивом.
При змішуванні водного розчину препарату з водним розчином бромціану і аніліну утворюється золотисто-жовтий розчин.
Вітамін В6 ( піридоксин, антидерматичний вітамін).
Терміном піридоксин об’єднуються три взаємоперетворювані сполуки, що є похідними піридину з різними замісниками:
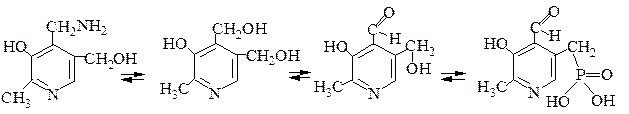 Піридоксамін Піридоксол Піридоксаль Піридоксальфосфат
Піридоксамін Піридоксол Піридоксаль Піридоксальфосфат
Всі три форми є попередниками коферментних форм піридоксальфосфату (ПАЛФ та піридоксамінофіосфату(ПАМФ), що приймають участь у каталітичних процесах ферментів обміну амінокислот. Добова потреба 2-3 мг.
Ідентифікацію препарату підтверджують реакцією: а) з феруму(III) хлоридом, утворюється червоне забарвлення; б) утворенням азобарвника з 2,6-дихлорхінонхлорімідом, який екстрагують бутиловим спиртом. Шар спирту забарвлюється в блакитний колір. Реакцію проводять в присутності амонійного буфера.
Кількісне визначення проводять ацидиметрією в неводному середовищі, в присутності меркурію ацетату, індикатор – кристалічний фіолетовий.
Питання для самопідготовки
1. Як класифікують вітаміни за їх фізичними властивостями?
2. Хімічна класифікація вітамінів.
3. Хімічна будова кислоти аскорбінової.
4.Відновні реакції, які лежать в основі визначення тотожності вітаміну С.
5.Склад кислоти аскорбінової для ін’єкцій і особливості її кількісного визначення.
6. Назвіть вітаміни групи В. До якого класу сполук вони належать?
Тестові завдання
1. Вітамінними засобами є:
А) аміналон; В) аскорбінова кислота; С) пірацетам; Д) калію ацетат.
2. Підтвердити кислотність аскорбінової кислоти можна
А) метилоранжем; В) лакмусом; С) фенолфталеїном; Д)універсальним індикатором.
3. З розчином феруму (ІІІ) хлоридом реагують:
А) калію ацетат; В) натрію саліцилат; С) кислота аскорбінова; Д) калію йодид.
4. Кислоту аскорбінову кількісно визначають:
А) кислотно-основним титруванням в середовищі оцтової льодяної кислоти; В) йодометрично; С) алкаліметрією; Д) комплексонометрією.
5. Кислота аскорбінова утворює сіль з:
А) аргентуму нітратом; В)натрію гідрокарбонатом;
С) феруму (ІІІ) хлоридом; Д) феруму (ІІ) сульфатом.
ЛІКАРСЬКІРЕЧОВИНИ ГРУПИ АНТИБІОТИКІВ ТА ЇХ НАПІВСИНТЕТИЧНИХ АНАЛОГІВ
Антибіотики – це хіміотерапевтичні речовини, які продукуються різноманітними мікроорганізмами, рослинами, тваринами в процесі життєдіяльності, а також їх синтетичні аналоги і похідні, що мають здатність знищувати чи вибірково пригнічувати ріст збудників захворювань (бактерій, вірусів, грибів, найпростіших) або затримувати розвиток злоякісних пухлин.
Вперше запропонував використати антагонізм мікроорганізмів для боротьби з патогенними мікробами І. І. Мечников.
Антибіотики активно втручаються в життєдіяльність патогенних мікробів, діючи бактеріостатично або бактерицидно.
Широке використання антибіотиків як лікарських засобів має місце у медицині, ветеринарії, різноманітних галузях сільського господарства, харчової і консервної промисловості.
Існує декілька принципів класифікації антибіотиків:
за видами продуцента;






