Ф.24
УДК 54:615.1
Автори: Мещишен І.Ф. – завідувач кафедри медичної хімії Буковинського державного медичного університету, доктор біологічних наук, професор, академік АН України, лауреат премії ім. Омеляна Поповича; Стаднійчук Р.Ф. – кандидат хімічних наук, викладач кафедри медичної хімії Буковинського державного медичного університету; Кадельник Ю.В. – асистент кафедри медичної хімії Буковинського державного медичного університету; Велика А.Я. – викладач кафедри медичної хімії Буковинського державного медичного університету; Панасенко Н.В. – ст. лаборант кафедри медичної хімії Буковинського державного медичного університету.
Стаднійчук Р.Ф., Мещишен І.Ф., Кадельник Ю.В., Велика А.Я., Панасенко Н.В.
Ф24 Фармацевтична хімія. Навчальний посібник./За загальною редакцією проф. І. Ф. Мещишена. – Чернівці: Медуніверситет, 2007. – 208 с.
ISBN 978-966-697-231-9
У навчальному посібнику охарактеризовано предмет і завдання фармацевтичної хімії, розглянуто класичні методи встановлення чистоти та ідентичності лікарських засобів, подано приклади їх добування та методи кількісного визначення. Матеріал розглянутий на прикладі найбільш характерних представників окремих груп лікарських речовин.
Посібник рекомендований для вивчення фармацевтичної хімії студентами-фармацевтами І-ІV рівнів акредитації.
Рецензенти: Косуба Р.Б. – доктор медичних наук, професор, завідувач кафедри фармації Буковинського державного медичного університету; Заморський І.І. – доктор медичних наук, професор, завідувач кафедри фармакології Буковинського державного медичного університету; Лявинець О.С. – доктор хімічних наук, професор, завідувач кафедри органічної, фармацевтичної та екологічної хімії Чернівецького національного університету імені Ю. Федьковича; Прийменко Б.О. – доктор фармацевтичних наук, професор, завідувач кафедри органічної хімії Запорізького державного медичного університету; Фіра Л.С. – доктор біологічних наук, професор, завідувач кафедри фармакогнозії з медичною ботанікою Тернопільського державного медичного університету
ім. І.Я. Горбачевського.
© Стаднійчук Р.Ф., Мещишен І.Ф.,
Кадельник Ю.В., Велика А.Я.,
Панасенко Н.В., 2007
ISBN 978-966-697-231-9 © Медуніверситет, 2007
Передмова
Запропонований посібник призначений для студентів-фармацевтів вищих медичних (фармацевтичних) навчальних закладів І-IV рівнів акредитації. В його основу покладена програма з фармацевтичної хімії для спеціальностей “Аналітичний контроль якості хімічних лікарських сполук”, “Виробництво фармацевтичних препаратів”, “Фармація”. Посібник побудований на основі хімічної класифікації лікарських засобів, іноді використовується хіміко-фармакологічна класифікація.
Основним завданням посібника є формування знань, умінь і навичок, необхідних для проведення контролю якості лікарських речовин, описаних в Державній фармакопеї України.
У викладенні матеріалу застосована схема, яка відображає взаємозв’язок практичних завдань з теоретичними положеннями, які використовуються для їх вирішення. Таким чином, студенти знайомляться із загальними принципами у підході до оцінки якості лікарських засобів і використовують їх для вирішення найбільш характерних практичних завдань фармацевтичного аналізу, які гарантують ефективність застосування лікарських речовин.
Автори сподіваються, що запропонований посібник допоможе студентам глибоко засвоїти теоретичний матеріал і свідомо підійти до виконання практичної роботи з аналізу лікарських засобів.
Автори
ВСТУП. ЗАГАЛЬНІ ПОЛОЖЕННЯ ПРО АНАЛІЗ ЛІКАРСЬКИХ ЗАСОБІВ
Фармацевтична хімія – наука, що вивчає способи одержання лікарських речовин, їх будову, фізичні і хімічні властивості, зв’язок між будовою і дією на організм, стабільність, а також методи контролю якості, умови зберігання та відпуску.
Фармацевтична хімія використовує закони неорганічної, органічної, фізичної хімії і тому є прикладною хімією. З іншого боку, вона відноситься до медико-біологічних дисциплін, тому що широко використовує досягнення медичних наук: мікробіології, фізіології, фармакології, фармакогнозії, токсикології, біологічної хімії.
Основними завданнями фармацевтичної хімії є наступне: 1. Вивчення зв’язку між хімічним складом, структурою лікарських речовин та їх дією на організм; на основі цього синтезуються нові лікарські речовини, які викликають бажану фармакологічну дію. 2. Вивчення властивостей природних сполук, їх структури, механізму дії на організм.
Це розширює уявлення про зв’язок між будовою і дією на організм і дає можливість синтезувати речовини з подібною дією, але менш токсичні.
Велика кількість найрізноманітніших лікарських засобів, якими користується медицина, вимагає їхньої класифікації. Її проводять за фармакологічними або за хімічними ознаками. Можливі два основних види класифікації:
1) Фармакологічна класифікація, коли всі лікарські засоби діляться на групи в залежності від їх дії на системи, процеси і виконавчі органи, як наприклад серце, головний мозок і т.д. У відповідності з цим лікарські засоби об’єднуються в групи наркотичних, снодійних, заспокійливих, місцевоанестезуючих, болезаспокійливих, діуретичних і т. д засобів.
2) Хімічна класифікація, у відповідності з якою лікарські речовини групуються за спільністю хімічної структури і хімічних властивостей.Цей принцип дає змогу встановити залежність між структурою і дією фармацевтичних препаратів і тому є особливо цінним для науки.
За хімічною природою лікарські засоби поділяють на неорганічні і органічні. Неорганічні речовини розглядають за групами елементів періодичної системи.У більшості випадків носіями фізіологічної активності є катіони.
Основна кількість лікарських засобів належить до органічних сполук. Їх класифікують за функціональними групами (вуглеводні, галогенопохідні, спирти, альдегіди і т.д.).Особливе місце займають гетероциклічні сполуки, до яких належать такі важливі лікарські засоби, як більшість антибіотиків, вітамінів та алкалоїдів.
Основними джерелами добування лікарських засобів є мінеральна сировина, нафта, кам’яновугільна смола, рослинна і, рідше, тваринна сировина, продукти життєдіяльності різних мікробів і променистих грибів, що утворюють антибіотики тощо.
Аналіз та ідентифікація лікарських речовин мають велике значення для охорони здоров’я. Метою аналізу є встановлення вмісту діючих речовин у готових препаратах, а також визначення чистоти препаратів. Лікарські засоби можуть бути забруднені продуктами побічних реакцій або продуктами, що надходять з допоміжних хімічних реактивів і апаратури.
У кожній державі вся продукція, що виробляється фармацевтичною промисловістю, повинна відповідати певним вимогам, викладеним у спеціальних документах. Основним документом, що нормує якість лікарських засобів є Державна фармакопея (національна).
Фармакопея – це офіційний збірник стандартів і обов’язкових норм для медикаментів, лікарської сировини та препаратів, що застосовуються для виготовлення лікарських форм. В Україні зараз користуються ДФ Х і ДФ ХІ. З лютого 1998 р. в Україні розпочало створення власної Державної фармакопеї.
Якість лікарського засобу зумовлює можливість медичного застосування. На основі аналітичних досліджень створюється нормативно-технічна документація (НТД) на лікарську речовину. Передбачаються наступні категорії НТД: фармакопейна стаття (ФС) і тимчасова фармакопейна стаття (ТФС). У фармакопейних статтях лікарські засоби розглядаються за таким принципом.
1) В назві фармакопейної статті дається назва препарату на латинській і українській (російській) мовах, структурна формула препарату, емпірична і молекулярна маса.
2) В розділі „Опис” приводять показники зовнішнього вигляду (колір, структуру, а також запах, іноді смак.
3) В розділі „Розчинність” вказують розчинність у воді, спирті, ефірі, хлороформі і ін. розчинниках.
4) 4. В розділі „Тотожність” приводять 2-3 хімічних реакції, які є найбільш специфічними для даного препарату. Далі ідуть розділи, в яких відображені випробування на доброякісність препарату, вказуються специфічні домішки і їх дослідження., органічні домішки та інші.
Важливим розділом є „ Кількісне визначення”, в якому описується методика кількісного визначення препарату.Далі ідуть розділи „Упаковка”, „Зберігання”, „Транспортування”, „Термін зберігання”. В розділі „Основна фармакологічна дія” описується основна фармакологічна дія лікарського засобу.
В окремих статтях фармакопеї зазначено, що в деяких лікарськиї засобах допускаються різні сторонні речовини, які називаються домішками. Якісний і кількісний склад домішок для кожного лікарського засобу визначається експериментально та регламентується фармакопеєю. Коли виконується аналіз на доброякісність лікарського препарату, то цим визначається, чи не перевищує кількість тієї чи іншої домішки межу встановлену фармакопеєю. Державна фармакопея не вимагає абсолютно чистого лікарського засобу і допускає в ньому наявність домішки в строго окреслених межах. Ця допустима межа визначається фізіологічною дією домішки на організм та впливом на властивості і стійкість лікарського засобу. Тому в різних лікарських препаратах одні й ті самі домішки допускаються в різних кількостях.
Наявність домішок не є випадковою, а зумовлена певними причинами. Джерела і причини появи домішок у лікарських засобах наступні:
1.) Це аппаратура, вихідна сировина, розчинники і інші речовини, які використовуються при добуванні препарату. Матеріал, з якого виготовлена апаратура (метал, скло), може бути джерелом домішки важких металів і миш’яку. При недбалому очищенні в лікарських засобах можуть міститись домішки розчинника, волокна фільтрувального паперу,пісок, азбест, тощо, а також домішки кислот і лугів.
2.) Дуже часто небажані домішки в лікарських препаратах утворюються внаслідок їх неправильного зберігання, коли не були враховані властивості лікарської речовини або порушені умови зберігання. Відбувається розклад речовини з утворенням продуктів, шкідливих для організму.
При встановленні доброякісності препарату необхідно враховувати і фармацевтичну дію домішки. Іноді одна й та ж сама домішка допускається в певній кількості в одному препараті і зовсім не допускається в іншому.
Таким чином, при випробуванні на чистоту, в залежності від характеру досліджуваної речовини і ступеня шкідливості для нього тієї чи іншої домішки. Державна фармакопея або вимагає повної відсутності домішок, або дає певну для даного препарату максимально допустиму границю, яка не впливає на якість препарату і його лікувальний ефект.
Для визначення допустимої межі домішок в препараті в Державну фармакопею введені так звані еталонні розчини. Результат реакції на ту чи іншу домішку в препараті порівнюється з результатами реакції, проведеної тими ж реактивами і в тому ж об’ємі з еталонним, стандартним розчином. Співставлення досліджуваного розчину з еталонним дає можливість судити про відсутність чи наявність домішки в більшій чи меншій кількості у порівнянні з еталоном. Приготування еталонних розчинів проводять за методиками,описаними в фармакопеї. Оскільки еталонні розчини –це розчини з точною концентрацією того чи іншого іона, то якісні випробування на домішки набувають кількісного значення. Тому можна сказати не лише яка домішка, а й скільки її є.
Для встановлення чистоти лікарських речовин використовують фізичні, хімічні і фізико-хімічні методи аналізу.
Питання для самоконтролю:
1. Назвіть основні пункти дослідження лікарської речовини.
2. Джерела домішок в лікарських препаратах.
3. Класифікація домішок: допустимі, недопустимі, специфічні та неспецифічні.
4. В яких випадках використовують безеталонний і еталонний метод визначення домішок?
5. Визначити наважку натрію хлориду, необхідну для приготування 1 л еталонного розчину хлорид-іону, концентрація якого 0,002 мг/мл, тобто 0.0002%.
6. Зробіть перелік розчинників, які найчастіше використовуються для вивчення розчинності лікарських препаратів.
Тестові завдання
1. Основним документом, який регламентує якість лікарського засобу є:
А) державна фармакопея; В) Фармакопейна стаття;
С) НТД; Д) Всі відповіді вірні;
2. Основним завданням фармацевтичної хімії є:
А) вивчення хімічних властивостей лікарських засобів;
В) вивчення фізичних властивостей;
С) вивчення методів аналізу, фізико-хімічних властивостей і фізіологічної дії лікарських засобів.
3. Які документи нормують якість лікарських речовин, що випускаються в Україні:
А) ДФУ; В) ДФХ;
С) Європейська фармакопея; Д) всі відповіді вірні
4. Кількість домішки в препараті вказана в ФС. Виберіть метод визначення домішки:
А) безеталонний; В) еталонний;
С) визначати домішку не потрібно; Д) всі відповіді вірні.
МЕТОДИ АНАЛІЗУ ЛІКАРСЬКИХ ПРЕПАРАТІВ
Аналіз лікарської речовини або сировини необхідно починати обов’язково із зовнішнього огляду, звертаючи увагу на колір, запах, форму кристалів, тару, упаковку, колір скла і т.д.
Після зовнішнього огляду беруть середню пробу для аналізу.
Методи дослідження лікарських речовин поділяються на фізичні, хімічні, фізико-хімічні і біологічні.
До фізичних методів дослідження відносяться: визначення розчинності, прозорості і ступеня мутності (для рідких лікарських речовин); визначення густини (для рідких препаратів), температури топлення, затвердіння, кипіння, визначення вологості і.т.д.
До хімічних методів відносяться: дослідження якісного складу лікарського засобу, зольності, реакції середовища (рН), визначення характерних числових показників жирів і масел: кислотне число, йодне число, “число омилення”. Сюди ж відносяться вагові і об’ємні методи кількісного аналізу, які прийняті в аналітичній хімії. Якісний і кількісний аналіз органічних лікарських засобів проводять за функціональними групами.
Зараз в практиці фармацевтичного аналізу знаходять широке застосування фізико-хімічні методи дослідження, як більш точні і швидкі за своїм виконанням. До них відносяться:
Оптичні методи, в основу яких покладені оптичні властивості речовин(рефрактометричний, поляриметричний, фотометричний і ін).
Електрохімічні методи аналізу, які включають потенціометричний, полярографічний, кондуктометричнийі деякі інші методи.
Велике практичне застосування набрав хроматографічний, адсорбційний метод: іонообмінна хроматографія, тонкошарова, паперова та інші види хроматографії.
В останні роки намітилась тенденція до широкого застосовання спектральних методів аналізу: інфрачервона і ультрафіолетова спектроскопія,спектроскопія ядерно-магнітного резонансу і ін.
Але не до всіх речовин можна застосовувати хімічні і фізико-хімічні методи аналізу. Іноді внаслідок певної будови речовини підібрати специфічні хімічні реакції і точні методи кількісного визначення не вдається, тим більше що хімічна будова багатьох природних речовин з сильною біологічною дією часто залишається не виясненою. В зв’язку з цим з’являється необхідність біологічного методу дослідження, який характеризує силу фармакологічної дії препарату
Біологічні дослідження препарату проводять на тваринах і, рідше, на окремих ізольованих органах або частинах органів тварин.
Основними і обов’язковими етапами дослідження лікарських засобів є: ідентифікація лікарського засобу, встановлення його чистоти, проведення кількісного аналізу.
Встановлення тотожності лікарських засобів. Для ідентифікації ЛЗ в ДФ використовується комплекс досліджень: характеристика зовнішнього вигляду, розчинність, температури плавлення, температурних границь перегонки, питомого обертання, значення величини рН, питомого показника поглинання та інших показників в ультрафіолетовій або видимій області спектра, хімічних реакцій на катіони, аніониабо функціональні групи та ін.
Характеристика зовнішнього виду. В індивідуальній статті на кожний лікарський засіб в розділі „Опис” в ДФ дається характеристика головним чином фізичних властивостей (агрегатний стан, колір, запах), вказується чи є дана речовина кристалічною, аморфною, розміри кристалів, їх форма, іноді приводяться додаткові дані (важкий, легкий, рихлий порошок і ін.)
Агрегатний стан лікарського засобу має велике значення для характеристики його якості. Відомий взаємозв’язок ступеня дисперсності кристалів з хімічною і фармакологічною активністю ЛЗ.
Зовнішній вигляд ЛЗ може змінюватися під впливом різних факторів оточуючого середовища:світла, вологи, температури, кисню, діоксиду вуглецю і інших газів), що виражається в зволоженні, зміні кольору, випадінні осадів. При цьому можуть проходити хімічні реакції: окиснення, відновлення, осадження, гідролізу. Для правильного висновку про відповідність зовнішнього вигляду ЛЗ вимогам ДФ, важливо вміти пов’язати його зміну з хімічними реакціями, які можуть відбутись під впливом факторів оточуючого середовища. Провізор повинен забезпечити правильне зберігання лікарського засобу.
Розчинність. Для позначення розчинності ЛЗ в ДФ прийняті умовні терміни:„ дуже легко розчинний”, „розчинний”, „практично нерозчинний” та ін., які визначають співвідношення об’єму розчинника до однієї вагової частини лікарської речовини. ДФ характеризує розчинність лікарського засобу, як правило, у воді, а також в інших розчинниках: частіше –в 95% спирті, хлороформі, ефірі, рідше – в кислотах і лугах. Зміна розчинності лікарської речовини вказує на присутність або появу в процесі зберігання менш розчинних домішок, таким чином, характеризує зміну його якості.
Визначення тотожності хімічними реакціями. В нормативних документах (НД) приводяться групові і специфічні хімічні реакції для ототожнення лікарських речовин.
Велика кількість лікарських засобів містить один і той же іон або одну і ту ж функціональну групу. Це дозволило створити уніфіковані методики для їх ідентифікації з допомогою хімічних реакцій і об’єднати в фармакопейну статтю.
Загальні реакції на тотожність
Амоній. При нагріванні розчинів солей амонію з розчинами лугів виділяється аміак, який можна визначити за характерним запахом або за посинінням вологого лакмусового папірця:
NH4+ + OH‾ → NH3↑ + H2O
Ацетати. Ацетати визначають реакцією утворення складного ефіру – етилацетату, який має характерний запах свіжих яблук (в присутності конц. сульфатної кислоти при нагріванні):
СН3COOH + C2H5OH → CH3COOC2H5 + H2O
Другим випробуванням на ацетат-іон, включене в ДФ, є його взаємодія з заліза(ІІІ) хлоридом. При додаванні до нейтрального розчину, який містить ацетат-іон, розчину заліза(Ш) хлориду з’являється червоно-буре забарвлення внаслідок утворення заліза(Ш) ацетату або гідроксиацетату, що утворюється на 1-й стадії гідролізу середньої солі:
Fe3+ + 3 CH3COOˉ ↔ Fe(CH3COO)3 або
Fe3+ + 3CH3COOˉ + H2O ↔ Fe (CH3COO)2(OH) + CH3COOH
Бензоати. Нейтральні розчини бензоатів з заліза(Ш) хлоридом утворюють осад рожево-жовтого кольору, розчинний в ефірі:
6С6H5COOˉ + 2Fe3+ +10H2O → (C6H5COO)3Fe∙Fe(OH)3∙7H2O+ 3CH3COOH
Одержаний осад руйнується при дії кислот і основ.
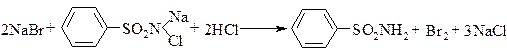 |
Броміди ідентифікуються за реакцією виділення брому в окисно-відновній реакції між бромідом і хлораміном в кислому середовищі. Реакцію проводять в присутності хлороформу. Хлороформний шар забарвлюється в жовто-бурий колір:
Розчини бромідів з розчином аргентуму нітрату утворюють жовтуватий осад аргентуму броміду, нерозчинний в нітратній кислоті і важко розчинний в розчині аміаку.
Вісмут. Розчини солей вісмуту, підкислені хлоридною кислотою хлороводневою утворюють коричнево-чорний осад з сульфідами.
Ферум (ІІ). Розчини солей феруму(ІІ) з гексаціаноферрат(ІІІ) – іоном утворюють синій осад гексаціаноферату (ІІІ) феруму(ІІ). Осад нерозчинний в мінеральних кислотах; руйнується при дії лугів:
Fe2+ + 2K3[Fe(CN)6] → Fe3 [Fe(CN)6]2 ↓
Ферум(ІІІ). Розчини солей феруму (ІІІ) утвороюють з розчином гексаціаноферат(ІІ) калію синій осад берлінської лазурі:
Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6↓
В реакції з тіоціанатами розчини солей феруму(Ш) утворюють сполуки червоного кольору:
Fe3+ + 3 SCN- → Fe(SCN)3
Йодиди. Йодиди є добрими відновниками, тому слабкі окислювачі виділяють молекулярний йод з йодидів. Йод забарвлює крохмаль в синій колір. ДФ рекомендує для окиснення йодидів розчини солі феруму(ІІІ) або натрію нітрит:
2КІ + 2NaNO2 + 2H2SO4 → I2 + 2NO + Na2SO4 + K2SO4 + H2O
Як окислювач ДФ пропонує також застосовувати кислоту сульфатну концентровану, при дії якої на йодиди виділяються фіолетові пари йоду.
З розчином аргентуму нітрату в присутності нітратної кислоти йодиди утворюють жовтуватий осад, нерозчинний в надлишку аміаку:
І‾ + Ag+ → AgI ↓
Калій. Солі калію з розчином винної кислоти утворюють білий кристалічний осад кислої солі. Реакцію проводять при охолодженні:
HO – CH - COOH HO ─ CH ─ COOK
K+ + │ → │ ↓ + H+
HO - CH - COOH HO ─ CH ─ COOH
білий
До реакційної суміші додають натрію ацетат:
СН3СООNa + H+ → CH3COOH + Na+
Утворенню осаду сприяє додавання 95% спирту і струшування пробірки.
Осад нерозчинний в оцтовій кислоті, але розчинний в мінеральних кислотах і розчинах лугів.
З розчином гексанітритокобальтату (Ш) натрію солі калію утворюють жовтий кристалічний осад гексанітритокобальтату (Ш) калію і натрію, який нерозчинний в оцтовій кислоті, але розчинний в мінеральних кислотах:
2К+ + Na+ + [Co(NO2)6]3‾ → K2Na[Co(NO2)6↓
З даним реактивом утворюють осад також солі аммонію, тому сіль калію попередньо прокалюють для видалення солей амонію.
Сіль калію, внесена в безбарвне полум’я, забарвлює його в фіолетовий колір, а коли дивитись на нього через синє скло, то полум’я буде пурпурово-червоним.
 |
Кальцій. Розчини солей кальцію з оксалат-іоном утворюють білий осад нерозчинний в оцтовій кислоті і розчинний в розведених мінеральних кислотах:
Сіль кальцію, змочена хлоридною кислотою, забарвлює безбарвне полум’я в цегляно-червоний колір.
Карбонати і гідрокарбонати. При дії на карбонати і гідрокарбонати розведених кислот виділяється газ СО2:
CO32- + 2H+ → CO2↑ + H2O
HCO3- + H+ → CO2↑ + H2O
При пропусканні диоксиду карбону через вапняну воду утворюється осад кальцію карбонату:
СО2 + Ca(OH)2 → CaCO3↓ + H2O
Відрізнити карбонати від гідрокарбонатів можна за реакцією середовища з використанням індикатора – фенолфталеїну. Карбонати і гідрокарбонати в розчині піддаються гідролізу:
СО32- + Н2О → НСО3 ‾ + ОН‾
НСО3‾ + Н2О → СО2 + Н2О + ОН‾
Карбонати мають більш лужну реакцію середовища, на відміну від гідрокарбонатів, в розчинах яких відбувається, крім гідролізу, дисоціація НСО3‾ - іону:
НСО3‾ ↔ СО32‾ + Н+
В зв’язку з цим реакція середовища гідрокарбонатів стає слабколужною. Тому розчини карбонатів забарвлюють фенолфталеїн в рожевий колір, а розчини гідрокарбонатів не забарвлюють його.
З насиченим розчином магнію сульфату розчини карбонатів утворюють білий осад:
Na2CO3 + 4MgSO4 + 4H2O → 3MgCO3∙Mg(OH)2∙3H2O↓ + 4Na2SO4 + CO2
Розчини гідрокарбонатів утворюють такий же осад, але при кип’ятінні суміші (гідрокарбонат при цьому переходить в карбонат):
2NaHCO3 → Na2CO3 + CO2 + H2O
Магній. Солі магнію утворюють з розчином натрію фосфату в присутності амонію хлориду білий кристалічний осад магній-амоній фосфату, розчинний в оцтовій кислоті:
MgSO4 + Na2HPO4 + NH3 → MgNH4PO4↓ + Na2SO4
MgNH4PO4 + H+ → Mg2+ +NH4+ + HPO42-
HPO42- + H+ ↔ H2PO4-
Для запобігання утворенню осаду магнію гідроксиду до реакційної суміші додають амонію хлорид.Слід пам’ятати, що надлишок амонію хлориду може привести до утворення розчинних комплексних іонів [MgCI3]‾, [MgCI4]2‾.
Миш’як в лікарських засобах присутнійу вигляді сполук, в яких ступінь окиснення його дорівнює +3 і +5, тому в ДФ приводяться реакції на арсеніти (AsO33‾) і арсенати (AsO43‾).
В середовищі хлоридної кислоти арсеніти і арсенати утворюють жовті осади з сульфід-іоном:
AsO33‾ + 6H+ → As3+ + 3H2O
As3+ + 3S2‾ → As2S 3↓
З розчином аргентуму нітрату арсеніти утворюють жовтий осад аргентуму арсеніту, який розчиняється в нітратній кислоті і розчині аміаку:
AsO33‾ + 3Ag+ → Ag3AsO3↓
Арсенати з розчином аргентуму нітрату утворюють коричневий осад аргентуму арсенату, який також розчинний в нітратній кислоті і розчині аміаку.
З іонами магнію і амонію в присутності амонію хлориду арсенати утворюють білий кристалічний осад, розчинний в розведеній хлоридній кислоті. Цією реакцією можна відрізнити арсенати від арсенітів:
AsO43‾ + Mg2+ + NH4+ → MgNH4AsO4↓
Натрій. Сіль натрію, внесена в безбарвне полум’я, забарвлює його в жовтий колір. Солі натрію утворюють жовтий кристалічний осад з цинку уранілацетатом. Осад нерозчинний в оцтовій кислоті:
Na++ Zn2++[(UO2)3(CH3COO)8]2-+CH3COOH+6H2O→ NaZn[(UO2)3(CH3COO)9] ∙6H2O↓+H+
 |
Нітрати. Загальною реакцією на нітрати і нітрити є реакція з дифеніламіном,яка грунтується на окисненні цього реактиву в присутності концентрованої сульфатної кислоти до дифенілдифенохінондиіміна гідросульфату, забарвленого в синій колір. Розчин дифеніламіну готується на конц. Н2SO4:
Нітрати можна відкрити, використовуючи реакцію з концентрованою Н2SO4 і металічною міддю за виділенням бурих парів диоксиду нітрогену:
NaNO3 + H 2SO4 →NaHSO4 + HNO3
Cu + 4HNO3 → Cu(NO3)2 + NO2↑ + 2H2O






