альц≥й отримують електрол≥зом кальц≥й хлориду або алюмотерм≥чним методом:
—а—l2 → —а + —l2
2Al + 6CaO → Ca3(AlO3)2 + 3Ca
ћагн≥й одержують в≥дновленн€м вуглецем при температур≥ 2000∞—:
MgO + C → CO + Mg
альц≥й та ћагн≥й мають сильн≥ в≥дновн≥ властивост≥, поступаючись лише лужним металам. ¬насл≥док х≥м≥чноњ активност≥ переважна б≥льш≥сть б≥нарних сполук цих метал≥в може бути одержана пр€мим синтезом ≥з простих речовин. ѕри високих температурах магн≥й ≥ кальц≥й реагують з галогенами, азотом, с≥ркою, фосфором, вуглецем та кремн≥Їм з утворенн€м в≥дпов≥дних галоген≥ д≥в, н≥трид≥в, сульф≥д≥в, карб≥д≥в та сил≥цид≥в:
3Ca + Br2 → CaBr2
3Mg + N2 → Mg3N2
Ca + S → CaS
3Mg + 2P → Mg3P2
Ca + 2C → CaC2
2Mg + Si → Mg2Si
ћагн≥й ≥ кальц≥й при нагр≥ванн≥ окиснюютьс€ воднем з утворенн€м г≥дрид≥в Ц кристал≥чних речовин з ≥онною структурою:
Ca + H2 → CaH2
√≥дриди легко реагують з водою з утворенн€м г≥дроксид≥в:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
ѕри п≥двищенн≥ температури кальц≥й ≥ магн≥й згор€ють у пов≥тр≥ з утворенн€м оксид≥в:
2Ca + O2 → 2CaO
ќксиди кальц≥ю та магн≥ю у промислових масштабах одержують прожарюванн€м карбонат≥в (вапна чи магнезиту):
—а—ќ3 → —аќ + —ќ2
¬они взаЇмод≥ють з водою з утворенн€м в≥дпов≥дних г≥дроксид≥в.
—аќ + Ќ2ќ → —а(ќЌ)2
”с≥ оксиди ≥ г≥дроксиди лужноземельних метал≥в мають основн≥ властивост≥.
ƒе€к≥ х≥м≥чн≥ властивост≥ сполук альц≥ю ≥ ћагн≥ю наведен≥ у наступних реакц≥€х:
MgS + H2O → Mg(OH)2 + H2S
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3
Mg3P2 + 6H2O → 3Mg(OH)2 + 2PH3
CaO + SiO2  CaSiO3
CaSiO3
CaO + 3C  CaC2 + CO
CaC2 + CO
Ca(OH)2  CaO + H2O
CaO + H2O
Ca(OH)2 + CO2  CaCO3↓ + H2O
CaCO3↓ + H2O
Ca(OH)2 + HCl  CaCl2 + 2H2O
CaCl2 + 2H2O
Ќа в≥дм≥ну в≥д солей лужних метал≥в сол≥ кальц≥ю та магн≥ю малорозчинн≥.
” б≥олог≥чному кругооб≥гу речовин альц≥ю належить одна ≥з головних функц≥й. ¬≥н приймаЇ участь у процесах грунтоутворенн€, покращуЇ структуру грунт≥в, впливаЇ на реакц≥ю середовища ≥, €к насл≥док, рухом≥сть ≥нших б≥олог≥чно необх≥дних елемент≥в. альц≥й спри€Ї ф≥ксац≥њ атмосферногоь азоту, м≥нерал≥зац≥њ орган≥чних сполук ≥ вив≥льненню з них р≥зних поживних речовин. ÷ей елемент приймаЇ участь у синтез≥ б≥лкових речовин, спри€Ї утворенню хлороф≥лу, впливаЇ на перем≥щенн€ асим≥л€т≥в у рослинах. ѕри в≥дсутност≥ кальц≥ю у грунт≥ погано розвиваЇтьс€ коренева структура рослин.
≤они ћагн≥ю суттЇво впливають на окисно-в≥дновн≥ процеси у рослинах. ѕри магн≥Їв≥й нестач≥ у рослин п≥двищуЇтьс€ окисний потенц≥ал, п≥дсилюютьс€ окисн≥ процеси, що призводить до руйнуванн€ хлороф≥лу. ћагн≥й посилюЇ рухом≥сть фосфат≥в у грунт≥ ≥ надходженн€ њх до рослин, в≥н спри€Ї в≥дновним процесам у рослинах ≥ позитивно впливаЇ на б≥осинтез в≥дновлених сполук.
—ол≥ CaCO3 ≥ CaCO3 × MgCO3 Ц основн≥ речовини дл€ х≥м≥чноњ мел≥орац≥њ грунт≥в, завданн€ €коњ пол€гаЇ у л≥кв≥дац≥њ надлишковоњ кислотност≥ грунтвого розчину (вапнуванн€) або усуненн€ його надлишковоњ лужност≥ (г≥псуванн€).
≈кспериментальна частина
|
|
|
ƒосл≥д 7.2.1. ќдержанн€ водню при взаЇмод≥њ метал≥в з кислотами
” проб≥рку пом≥стити трохи алюм≥н≥Ївих стружок ≥ долити 1 мл розчину натр≥й г≥дроксиду. —постер≥гати вид≥ленн€ бульбашок газу. якщо реакц≥€ в≥дбуваЇтьс€ пов≥льно, обережно п≥д≥гр≥ти. —класти р≥вн€нн€ реакц≥њ.
ƒосл≥д 7.2.2. ќдержанн€ водню з кислот
” чотири проб≥рки пом≥стити по 1-2 шматочки Mg, Al, Fe, Sn ≥ долити у кожну з них по 1 мл розведеноњ (1:1) хлоридноњ кислоти. ўо при цьому спостер≥гаЇтьс€? ÷ей самий досл≥д виконати з розведеною (1:5) сульфатною кислотою. —класти р≥вн€нн€ реакц≥й.
ƒосл≥д 7.2.3. ¬и€вленн€ г≥дроген пероксиду
” проб≥рку до 3 крапель розчину кал≥й ≥одиду додати 2 крапл≥ розведеного розчину H2SO4 ≥ пот≥м по крапл€м додавати розчин H2O2 до по€ви жовтого забарвленн€. ¬ид≥ленн€ ≥одиду стаЇ б≥льш пом≥тним, €кщо внести в проб≥рку дек≥лька крапель бензолу. Ќаписати р≥вн€нн€ реакц≥й.
ƒосл≥д 7.2.4. атал≥тичне розкладанн€ г≥дроген пероксиду
Ќалити у проб≥рку 8-10 крапель 3%-вого розчину H2O2 ≥ внести трохи мангану д≥оксиду (катал≥затор). √аз, що вид≥л€Їтьс€ випробовують тл≥ючоњ ск≥бкою. Ќаписати р≥вн€нн€ реакц≥й.
ƒосл≥д 7.2.5. ћалорозчинн≥ сол≥ лужних метал≥в
7.2.5.1. як≥сна реакц≥€ на ≥он кал≥ю
–еактив натр≥й гексан≥тр≥токобальтату (III) Na3[Co(NO2)6] даЇ з розчинами солей кал≥ю жовтий осад 2Na[Co(NO2)6]. Ќа предметному скл≥ до 1 крапл≥ п≥дкисленого хлоридною кислотою сол≥ кал≥ю додати 1Ц2 крапл≥ розчину реактиву. „ерез де€кий час утворюЇтьс€ жовтий кристал≥чний осад. –озгл€нути форму кристал≥в, використовуючи м≥кроскоп. ≤онне р≥вн€нн€ маЇ такий вигл€д:
2 + + Na+ + [Co(NO2)6]3- → 2Na[Co(NO2)6]
ƒосл≥д 7.2.5.2. ”творенн€ магн≥й г≥дроксиду та його розчиненн€
у кислот≥ ≥ сол€х амон≥ю
” проб≥рку з розчином сол≥ магн≥ю додати по крапл€х розчин NaOH до утворенн€ осаду. ќсад розд≥лити на три частини ≥ пом≥стити у проб≥рки. ¬ першу додати по крапл€х концентрований розчин натр≥й г≥дроксиду, у другу Цконцентрований розчин хлоридноњ кислоти, в третю Ц насичений розчин амон≥й хлориду. ¬ €ких проб≥рках спостер≥гаЇмо розчиненн€ осаду? ѕро €к≥ властивост≥ це св≥дчить? Ќаписати в≥дпов≥дн≥ р≥вн€нн€ реакц≥й.
7.3. онтрольн≥ запитанн€
| 1. | ¬одень, його значенн€ €к найпоширен≥шого елемента ¬сесв≥ту. ќсновн≥ способи добуванн€ водню, його ф≥зичн≥ та х≥м≥чн≥ властивост≥. |
| 2. | «ак≥нчити р≥вн€нн€ реакц≥й, вказати умови њх проведенн€, €кщо вони в≥др≥зн€ютьс€ в≥д звичайних (нагр≥ванн€, катал≥затори, тиск ≥ т.≥н.): Na + H2O Ѓ Ca(HCO3)2 Ѓ H2S + I2 Ѓ Na2O2 + CO2 Ѓ |
| 3. | Ћужн≥ та лужноземельн≥ метали. Ќатр≥й ≥ кал≥й €к важлив≥ елементи ірунту та б≥олог≥чно активн≥ елементи. јтомн≥ характеристики, поширен≥сть, ф≥зичн≥ та х≥м≥чн≥ властивост≥. ал≥йн≥ добрива, њх основн≥ форми. |
| 4. | «ак≥нчити р≥вн€нн€ реакц≥й, вказати умови њх проведенн€, €кщо вони в≥др≥зн€ютьс€ в≥д звичайних (нагр≥ванн€, катал≥затори, тиск ≥ т.≥н.): P + H2SO4(конц) Ѓ CaH2 + H2O Ѓ H2S + I2 Ѓ K + O2 Ѓ |
| 5. | «агальна характеристика s-елемент≥в. ћагн≥й ≥ альц≥й, атомн≥ характеристики, поширен≥сть, ф≥зичн≥ та х≥м≥чн≥ властивост≥. |
ЋјЅќ–ј“ќ–Ќј –ќЅќ“ј є 8
’≤ћ≤я –-≈Ћ≈ћ≈Ќ“≤¬. ’≤ћ≤„Ќ≤ ¬Ћј—“»¬ќ—“≤ —ѕќЋ”
ј–ЅќЌ”, Ќ≤“–ќ√≈Ќ” “ј ‘ќ—‘ќ–”
“еоретична частина
арбон знаходитьс€ в IVј-груп≥ пер≥одичноњ системи елемент≥в. ≈лектронна формула: 1s22s22p2. ” нормальному стан≥ маЇ ступ≥нь окисненн€ +2, у збудженому стан≥ Ц +4.
|
|
|
¬углець Ц це складова частина нафти, природного газу, камТ€ного вуг≥лл€. ¬≥н зустр≥чаЇтьс€ в природ≥ у вигл€д≥ сполук та у в≥льному стан≥. ≤снують чотири алотроп≥чн≥ модиф≥кац≥≥ арбону: алмаз, граф≥т, карб≥н ≥ пол≥кумулен.
” в≥льному стан≥ арбон х≥м≥чно неактивний; в≥н вступаЇ в реак≠ц≥ю лише з дуже енерг≥йними окисниками. ѕри нагр≥ванн≥ х≥м≥ч≠на активн≥сть арбону зростаЇ. « металами та неметалами арбон реагуЇ лише при високих температурах:
Ca + 2C  CaC2
4Al + 3C CaC2
4Al + 3C  Al4C3
— + S2 Ѓ CS2
C + 2H2 Al4C3
— + S2 Ѓ CS2
C + 2H2  CH4 CH4
| C + O2  CO2
2C + O2 CO2
2C + O2  2CO
C + H2O 2CO
C + H2O  CO + H2↑
C + ZnO CO + H2↑
C + ZnO  CO↑ + Zn CO↑ + Zn
|
√оловними оксигеновм≥сними сполуками арбону Ї оксиди —ќ (чадний газ) ≥ —ќ2 (вуглекислий газ). „адний газутворюЇтьс€ при спалюванн≥ вуглецю або його сполук при нестач≥ кисню, а також внасл≥док взаЇмод≥њ карбон(IV) оксиду з розжареним вуг≥лл€м:
2— + ќ2 Ѓ 2—ќ,
—ќ2 + — Ѓ 2—ќ.
” лабораторних умовах —ќ добувають ≥з форм≥атноњ кислоти д≥Їю на нењ концентрованою сульфатною кислотою при нагр≥ванн≥ до 373 :
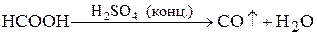 .
.
—ќ маЇ сильн≥ в≥дновн≥ властивост≥; при нагр≥ванн≥ здатний в≥днов-лювати де€к≥ метали з њх оксид≥в:
CO + 3Fe2O3 Ѓ CO2 + 2Fe3ќ4;
—ќ + Fe3ќ4 Ѓ —ќ2 + 3FeO;
CO + FeO Ѓ CO2 + Fe.
¬углекислий газ у промисловост≥ одержують при обпалюванн≥ вапн€ку:
CaCO3 Ѓ CaO + CO2≠,
а в лабораторних умовах Ц при д≥њ на мармур хлоридноњ кислоти:
—aCO3 + 2HCl Ѓ CO2≠ + H2O + CaCl2.
—ќ2Ц кислотний оксид, €кий взаЇмод≥Ї з водою, основними оксидами, лугами та амон≥аком:
—ќ2 + Ќ2ќ  Ќ2—ќ3
Ќ2—ќ3
—ќ2 + —аќ Ѓ —а—ќ3
—ќ2 + 2 ќЌ Ѓ 2—ќ3 + Ќ2ќ
—O2 + 2NH3 Ѓ CO(NH2)2 + H2O.
ѕри розчиненн≥ у вод≥ —ќ2 утворюЇтьс€ нест≥йку слабку карбонатну кислоту H2CO3, у розчин≥ €коњ встановлюЇтьс€ р≥вновага:
CO2 + Ќ2ќ  H2CO3
H2CO3 



як двохосновна кислота вона утворюЇ середн≥ (карбонати) та кисл≥ (г≥дрогенкарбонати) сол≥. арбонати ≥ г≥дрогенкарбонати терм≥чно нест≥йк≥. ѕри нагр≥ванн≥ г≥дрогенкарбонати переход€ть у карбонати:
2KHCO3  K2CO3 + H2O + CO2≠.
K2CO3 + H2O + CO2≠.
Cол≥ карбонатноњ кислоти можуть бути отриман≥ при д≥њ на CO2 луг≥в або за допомогою наступних обм≥нних реакц≥й:
ќЌ + CO2 Ѓ Ќ—ќ3;
Ќ—ќ3 + ќЌ Ѓ 2—ќ3 + Ќ2ќ;
¬аCl2 + Na2CO3 Ѓ BaCO3 ¯ + 2NaCl.
арбонати дуже легко розкладаютьс€ п≥д д≥Їю м≥неральних та слабких орган≥чних кислот
CaCO3 + 2CH3COOH Ѓ Ca(CH3COO)2 + CO2≠ + H2O.
”с≥ сол≥ карбонатноњ кислоти, окр≥м солей лужних метал≥в, амон≥ю та де€ких кислих солей, погано розчин€ютьс€ у вод≥.
” с≥льському господарств≥ ≥з сполук арбону використовуЇтьс€ дл€ вапнуванн€ кислих грунт≥в вапн€к —aCO3; у рослинництв≥ застосовують €к ≥нсектицид проти ф≥локсери та де€ких комах кал≥й т≥окарбонат 2CS3.
Ќ≥троген та ‘осфор Ї елементами Vј групи пер≥одичноњ системи. Ќа зовн≥шньому енергетичному р≥вн≥ атом≥в цих елемент≥в знаход€тьс€ пТ€ть електрон≥в s2p3, ≥з них три р-електрона. “ому в звичайному стан≥ вони мають валентн≥сть, €ка дор≥внюЇ трьом. —туп≥нь окисненн€ Ќ≥трогену в його сполуках зм≥нюЇтьс€ в широких межах: в≥д -3 до +5:
| -3 | -2 | +1 | +2 | +3 | +4 | +5 | |
NH3,
 NH4+ NH4+
| NH2Ц NH2 | N2 | N2O | NO | N2O3 HNO2 | NO2 N2O4 | N2O5 HNO3 |
¬насл≥док м≥цност≥ молекули азот х≥м≥чно малоактивний, при к≥мнатн≥й температур≥ реагуЇ лише з л≥т≥Їм, утворюючи л≥т≥й н≥трид:
6Li + N2 → 2Li3N
ѕри високих температурах ≥ в присутност≥ катал≥затор≥в Ќ≥троген взаЇмод≥Ї з неметалами (киснем, вуглецем, бором, кремн≥Їм), досить легко сполучаЇтьс€ з де€кими металами (Mg, Ca, Ti) з утворенн€м н≥трид≥в:
« неметалами:
N2 + O2  2NO↑
2¬ + N2 2NO↑
2¬ + N2  2BN
3Si + 2N2 2BN
3Si + 2N2  Si3N4 Si3N4
| « металами: N2 + 3Mg → Mg3N2 N2 + 3Ca → Ca3N2 |
¬заЇмод≥Їю азоту з воднем при п≥двищених температур≥ та тиску (“ = 450-500∞—, – = 30 мѕа) в присутност≥ зал≥зного катал≥затора в промисловост≥ синтезують амон≥ак:
N2 + 3H2  2NH3
2NH3
” лаборатор≥њ амон≥ак отримують нагр≥ванн€м сум≥ш≥ амон≥й хлориду з кальц≥й г≥дроксидом:
2NH4Cl + Ca(OH)2 → 2NH3↑ + 2H2O + CaCl2
” х≥м≥чному в≥дношенн≥ амон≥ак довол≥ активний ≥ ви€вл€Ї лише в≥дновн≥ властивост≥:
4 NH3 + O2  4NO + 6H2O
4NH3 + 3O2 4NO + 6H2O
4NH3 + 3O2  2N2 + 6H2O 2N2 + 6H2O
| NH3 + —а → —аNЌ + H2 2NH3 + 3Cl2 → N2 + 6HCl |
јмон≥ак легко розчин€Їтьс€ у вод≥ з утворенн€м амон≥й г≥дроксиду Ц слабкоњ основи:
|
|
|
NH3 + H2O  NH4OH
NH4OH
« ан≥онами кислот ≥он амон≥ю утворюЇ тверд≥ кристал≥чн≥ добре розчинн≥ речовини Ц сол≥ амон≥ю:
NH4OH + Ќ2SO4 → (NH4)2SO4 + 2H2O
2NH3 (надл.) + H3PO4 → (NH4)3–ќ4
NH3 + H2O + CO2 → NH4HCO3
—ух≥ амон≥йн≥ сол≥ при нагр≥ванн≥ розкладаютьс€ на амон≥ак та кислоту (цей процес називаЇтьс€ терм≥чною дисоц≥ац≥Їю):
NH4Cl → NH3 + HCl
« ќксигеном Ќ≥троген утворюЇ р€д оксид≥в: N2O, NO, N2O3, NO2, N2O4, N2O5. Ќ≥троген (III) оксид Ц кислотний оксид, €кий легко поглина-Їтьс€ лугами утворюючи н≥трити:
N2O3 + 2NaOH → 2NaNO3 + H2O
ƒ≥Їю на н≥трити розведеною сульфатною кислотою утворюють н≥тритну кислоту:
2NaNO2 + H2SO4 → 2HNO2 + Na2SO4
Ќ≥тритна кислота HNO2 Ц кислота середньоњ сили, €ка ≥снуЇ лише в дуже розведених водних розчинах. ѕри нагр≥ванн≥ ц€ кислота розклада-Їтьс€:
2HNO2  NO2 + NO + H2O.
NO2 + NO + H2O.
Ќ≥тритна кислота ≥ њњ сол≥ н≥трити мають окисно-в≥дновн≥ властивост≥, Ќ≥трити довол≥ ст≥йк≥ ≥ добре розчинн≥ у вод≥.
Ќ≥троген (V) оксид N2O5 маЇ сильн≥ окисн≥ властивост≥. ѕри розчиненн≥ у вод≥ в≥н утворюЇ сильну н≥тратну кислоту:
N2O5 + Ќ2ќ Ѓ 2HNO3.
” водному розчин≥ н≥тратна кислота дисоц≥юЇ майже повн≥стю:
HNќ3 → H+ + Nќ3-
¬она реагуЇ з оксидами та г≥дроксидами, з сол€ми ≥ неметалами:
2HNO3 + CaO → Ca(NO3)2 + H2O
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
2HNO3 + Ca—O3 → Ca(NO3)2 + H2O + —ќ2↑
5HNO3 + – → Ќ3–ќ4 + 5NO2↑ + H2O
6HNO3 + S → 6NO2↑ + Ќ2Sќ4 + 2H2O
4HNO3 + 3C → 4NO + 3CO2 + 2H2O
ѕри взаЇмод≥њ н≥тратноњ кислоти з металами утворюЇтьс€ с≥ль; водень, €к правило, не вид≥л€Їтьс€: в≥н окиснюЇтьс€, утворюючи воду. ислота в залежност≥ в≥д њњ концентрац≥њ та активност≥ металу, може в≥дновлюватись до сполук:
HNO3 → NO2 → HNO2 → NO → N2O → N2 → NH3(NH4NO3).
Ќ≥троген Ц один ≥з х≥м≥чних елемент≥в-органоген≥в, необх≥дних дл€ росту ≥ життЇд≥€льност≥ рослин. Ќезважаючи на те, що пов≥тр€ м≥стить 79% азоту, ≥снуЇ досить серйозна проблема його нестач≥ у грунт≥, внасл≥док €коњ спостер≥гаЇтьс€ затримка росту, ненормальний розвиток та ≥нш≥ хвороби рослин. ћолекули орган≥чних речовин, що м≥ст€ть азот, ви€вл€ють функц≥ональну активн≥сть по в≥дношенню до безл≥ч≥ реакц≥й живоњ кл≥тини, а також структуроутворюючу здатн≥сть.
—ол≥ н≥тратноњ кислоти (н≥трати) використовуютьс€ у с≥льському господарств≥ €к добрива. Ќ≥трати кальц≥ю, кал≥ю, амон≥ю та кальц≥ю називають сел≥трами.
‘осфор належить до поширених у природ≥ х≥м≥чних елемент≥в. ¬≥н входить до складу б≥лк≥в, тому без нього не можуть ≥снувати жив≥ орган≥зми. ¬ рослинах в≥н зосереджений у плодах та нас≥нн≥. ¬насл≥док своЇњ високоњ х≥м≥чноњ активност≥ у в≥льному стан≥ не зустр≥чаЇтьс€. ” звТ€зку з тим, що ‘осфор у природних сполуках знаходитьс€ в найвищому ступен≥ окисненн€ (+5), дл€ одержанн€ у в≥льному стан≥ його необх≥дно в≥дновити. ” рол≥ в≥дновника використовують вуглець:
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO2 + 2P + 5CO↑
‘осфор утворюЇ дек≥лька алотропних модиф≥кац≥й, найважлив≥ш≥ з них: б≥лий (отрута), червоний ≥ чорний фосфор.
ѕри взаЇмод≥њ з металами ви€вл€Ї окисн≥ властивост≥:
3Ca + 2– → —a3P2
¬ реакц≥€х з активними неметалами (киснем, галогенами, с≥ркою) ‘осфор виступаЇ €к в≥дновник.
4– + 5ќ2  2–2ќ5
2– + 5—l2 → 2PCl5
2– + 3S → P2S3 2–2ќ5
2– + 5—l2 → 2PCl5
2– + 3S → P2S3
| 4– + 3ќ2  2–2ќ3
2– + 3—l2 → 2PCl3
2– + 5S → P2S5 2–2ќ3
2– + 3—l2 → 2PCl3
2– + 5S → P2S5
|
« воднем фосфор безпосередньо не взаЇмод≥Ї, але утворюЇ летку при звичайн≥й температур≥ сполуку Ц фосф≥н PH3. ÷е безбарвний, отруйний газ. «а аналог≥Їю з амон≥аком в≥н взаЇмод≥Ї з сильними кислотами, утворюючи сол≥ фосфон≥ю:
|
|
|
PH3 + HClO4 → PH4ClO4
‘осф≥н Ц сильник в≥дновник. Ќа пов≥тр≥ окиснюЇтьс€ до ортофосфатноњ кислоти:
PH3 + 2ќ2 → Ќ3–ќ4
‘осфор утворюЇ з киснем р€д оксид≥в, серед €ких головними Ї –2ќ3 ≥ –2ќ5. ‘осфор (III) оксид –2ќ3 Ц кислотний оксид, €кий при взаЇмод≥њ з водою утворюЇ фосф≥тну кислоту:
–2ќ3 + Ќ2ќ → 2Ќ3–ќ3
‘осф≥тна кислота Ц кислота середньоњ сили, що маЇ окисно-в≥дновн≥ властивост≥:
Ќ3–ќ3 + 3Zn + 3H2SO4 → –H3 + 3ZnSO4 + 3H2O
Ќ3–ќ3 + Cl2 + H2O → Ќ3–ќ4 + 2HCl
‘осф≥тна кислота утворюЇ два типи солей Ц кисл≥ (г≥дрогенфосф≥ти) та середн≥ (фосф≥ти). Ѕ≥льш≥сть солей фосф≥тноњ кислоти нерозчинн≥ у вод≥.
‘осфор (V) оксид –2ќ5 одержують при повному згор€нн≥ фосфору у присутност≥ пов≥тр€ або кисню:
4P + 5O2 → 2–2ќ5
–2ќ5 Ц у х≥м≥чному в≥дношенн≥ кислотний оксид, це типовий анг≥дрид групи фосфорних кислот:
–2ќ5 + Ќ2ќ → 2Ќ–ќ3 Ц метафосфатна кислота
–2ќ5 + 2Ќ2ќ → Ќ4–2ќ7 Ц дифосфатна кислота
–2ќ5 + 3Ќ2ќ → 2Ќ3–ќ4 Ц ортофосфатна кислота
Ќайважлив≥шою з ус≥х кислот фосфору Ї ортофосфатна кислота Ц кислота середньоњ сили:
Ќ3–ќ4 + 3—аќ → —а3(–ќ4)2 + 3Ќ2ќ
Ќ3–ќ4 + ќЌ → Ќ2–ќ4 + Ќ2ќ
Ќ3–ќ4 + 2 ќЌ → 2Ќ–ќ4 + 2Ќ2ќ
Ќ3–ќ4 + 3 ќЌ → 3–ќ4 + 3Ќ2ќ
3—а—ќ3 + 2Ќ3–ќ4 → —а3(–ќ4)2 + 3Ќ2ќ + 3—ќ2↑
‘осфор належить до елемент≥в-органоген≥в ≥ в≥д≥граЇ дуже важливу роль у обм≥н≥ речовин. ¬≥н входить до складу протоплазми живоњ кл≥тини, хро≠мосом, в≥там≥н≥в, фермент≥в; бере участь в утворенн≥ б≥лк≥в та вуглевод≥в у рослинних орган≥змах.
” с≥льському господарств≥ щироко застосовуютьс€ фосфорн≥ добрива, найголовн≥шими ≥з €ких €ких Ї наступн≥:
CaSO4 + Ca(H2PO4)2 Ц проcтий суперфосфат
Ca(H2PO4)2 Ц подв≥йний суперфосфат
(NH4)2HPO4 + NH4H2PO4 Ц aмофос
CaHPO4 × 2H2O Ц прецип≥тат
≈кспериментальна частина
ƒосл≥д 8.2.1. ќдержанн€ ≥ властивост≥ солей карбонатноњ кислоти
8.2.1.1. ¬ластивост≥ карбонат≥в лужноземельних метал≥в
¬з€ти три проб≥рки. ¬ першу внести 4-5 крапель розчину сол≥ кальц≥й хлориду, в другу 4-5 крапель розчину сол≥ бар≥й хлориду, в третю Ц 4-5 крапель розчину сол≥ стронц≥й хлориду. ¬ кожну додати такий самий обТЇм розчину натр≥й карбонату. —постер≥гати випад≥нн€ осад≥в в≥дпов≥дних карбонат≥в. ƒодати розчин ацетатноњ кислоти в проб≥рки з осадами. ўо спостер≥гаЇтьс€? Ќаписати р≥вн€нн€ реакц≥й.
8.2.1.2. √≥дрол≥з натр≥й карбонату та г≥дрокарбонату
” дв≥ проб≥рки внести по 5-6 крапель дистильованоњ води ≥ по 2-3 крапл≥ розчину фенолфталењну. ѕот≥м в одну проб≥рку внести дек≥лька кристал≥в сол≥ Na2CO3, в другу Ц NaЌCO3. „и в обох проб≥рках в≥дбуваЇтьс€ г≥дрол≥з при звичайн≥й температур≥? —постер≥гати зм≥ну кольору ≥ндикатору. —класти р≥вн€нн€ реакц≥й г≥дрол≥зу вз€тих солей.
ƒосл≥д 8.2.2. √≥дрол≥з солей амон≥ю
Ќалити в одну проб≥рку розчин амон≥й хлориду, в ≥ншу Ц розчин амон≥й сульфату ≥ за допомогою лакмусу встановити реакц≥ю середовища. Ќаписати р≥вн€нн€ г≥дрол≥зу. яка з солей амон≥ю (хлоридна чи сульфатна) б≥льшою м≥рою п≥ддаЇтьс€ г≥дрол≥зу? „ому?
ƒосл≥д 8.2.3. ¬ластивост≥ н≥тратноњ кислоти та њњ солей
8.2.3.1. ” проб≥рку трохи налити концентрованого розчину натр≥й н≥триту ≥ долити розведену сульфатну кислоту, пот≥м охолодити. ¬изначити зм≥ну забарвленн€. Ќаписати р≥вн€нн€ реакц≥њ.
8.2.3.2. ” проб≥рку налити трохи розчину кал≥й дихромату ≥ розведеноњ сульфатноњ кислоти. ƒодати в розчин натр≥й н≥триту. “рохи нагр≥ти. —постер≥гати зм≥ну забарвленн€. —класти р≥вн€нн€ реакц≥й.
8.2.4. √≥дрол≥з солей ортофосфатноњ кислоти
” три проб≥рки налити по 1-1,5 мл дистильованоњ води. –озчинити дек≥лька кристалик≥в: у перш≥й проб≥рц≥ Ц натр≥й фосфату, у друг≥й Ц г≥дрофосфату, у трет≥й Ц диг≥дрофосфату. «а допомогою ун≥версальних ≥ндикаторних пап≥рц≥в вим≥р€ти рЌ розчин≥в у кожн≥й проб≥рц≥. ѕо€снити характер зм≥ни рЌ у вс≥х випадких. Ќаписати в≥дпов≥дн≥ реакц≥њ у молекул€рному та ≥онному вигл€д≥.
8.3. онтрольн≥ запитанн€
| 1. | «наченн€ арбону в природ≥. Ќеорган≥чн≥ сполуки арбону. ¬углекислий газ, карбонати, г≥дрокарбонати. арбон (≤≤) оксид. |
| 2. | «наченн€ Ќ≥трогену ≥ ‘осфору €к б≥огенних елемент≥в, њх кругооб≥г у природ≥. Ќ≥тратна кислота, њњ сол≥. |
| 3. | «апиш≥ть р≥вн€нн€ реакц≥й, що в≥дпов≥дають ланцюжку перетворень: амон≥ак Ѓ н≥троген (≤≤) оксид Ѓ н≥троген (≤V) оксид Ѓ н≥тратна кислота |
| 4. | ’≥м≥€ фосфору. ќксиди фосфору (III) та (V). ‘осфорн≥ кислоти, фосфати. ‘осфорн≥ добрива, виробництво, р≥зновиди та властивост≥. |
| 5. | «апиш≥ть р≥вн€нн€ реакц≥й, що в≥дпов≥дають ланцюжку перетворень: фосфор Ѓ фосфор (V) оксид Ѓ ортофосфатна кислота Ѓ кальц≥й диг≥дрогенфосфат |
| 6. | ’≥м≥€ Ќ≥трогену, його реакц≥њ з типовими елементами. јзотн≥ добрива. |
| 7. | «апиш≥ть р≥вн€нн€ реакц≥й, що в≥дпов≥дають ланцюжку перетворень: азот Ѓ л≥т≥й н≥трид Ѓ ам≥ак Ѓ азот |
| 8. | «апиш≥ть р≥вн€нн€ реакц≥й, що в≥дпов≥дають ланцюжку перетворень: фосфор Ѓ цинк фосф≥д Ѓ фосф≥н Ѓ фосфор (V) оксид |
| 9. | јм≥ак. ќсновн≥ способи отриманн€, ф≥зичн≥ та х≥м≥чн≥ властивост≥. —ол≥ амон≥ю. |
ЋјЅќ–ј“ќ–Ќј –ќЅќ“ј є 9
|
|
|
’≤ћ≤я –-≈Ћ≈ћ≈Ќ“≤¬. ’≤ћ≤„Ќ≤ ¬Ћј—“»¬ќ—“≤ —ѕќЋ”






