1. ‘ормулюванн€ пер≥одичного закону. (¬ар≥анти: спроби класиф≥кац≥њ х≥м≥чних елемент≥в; склад €дер атом≥в, х≥м≥чний елемент, ≥зотопи; значенн€ пер≥одичного закону тощо).
2. «аконом≥рност≥ зм≥ни рад≥ус≥в атом≥в у пер≥одах ≥ п≥дгрупах. (¬ар≥анти: зм≥на властивостей елемент≥в у пер≥одах ≥ п≥дгрупах; максимально можливе число електрон≥в на енергетичному р≥вн≥ (п≥др≥вн≥) ≥ ≥нш≥).
3. —к≥льки протон≥в ≥ нейтрон≥в м≥ститьс€ в €др≥ атома 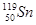 ?
?
4. Ќапиш≥ть повну електронну формулу елемента 41Nb ≥ п≥дкресл≥ть валентн≥ електрони.
5. Ќапиш≥ть х≥м≥чний символ елемента, зовн≥шн≥й електронний р≥вень €кого описуЇтьс€ формулою... 5d36s2.
6. як≥ з атом≥в, символи €ких умовно позначен≥ ј, Ѕ, ¬, √, ƒ, Ї ≥зотопами, а €к≥ Ц ≥зобарами? 


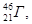

7. ¬каж≥ть можлив≥ ≥ неможлив≥ електронн≥ конф≥гурац≥њ: 1p1, 2d4, 3p5, 4s3, 5d11, 6p5. ¬≥дпов≥д≥ по€сн≥ть.
8. «апиш≥ть електронн≥ формули атом≥в зг≥дно заданих електронних формул йон≥в:
а) 1s22s22р6 (EЦ); б)1s22s22p63s23p6 (E2+); в) 1s22s22p6 (E3-).
9. Ќапиш≥ть електронн≥ конф≥гурац≥њ йон≥в: Be2+; Si4+; Sr2+; Br Ц.
10. Ќапиш≥ть електронн≥ формули елемент≥в, атоми €ких м≥ст€ть: а) на 3s-п≥др≥вн≥ два електрони; б) на 4d-п≥др≥вн≥ три електрони; в) на 5f-п≥др≥вн≥ 3 електрони.
«ј¬ƒјЌЌя Ќј —јћќ—“≤…Ќ” –ќЅќ“”
«авданн€ ≤
—к≥льки протон≥в ≥ нейтрон≥в м≥ститьс€ в €др≥ атома:
| ¬ | завданн€ | ¬ | завданн€ | ¬ | завданн€ |
 
| 
| 
| |||

| 
| 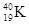
| |||

| 
| 
| |||

| 
| 
| |||

| 
| 
|
«авданн€ ≤≤
Ќапиш≥ть повну електронну формулу елемента ≥ п≥дкресл≥ть валентн≥ електрони:
| ¬ | завданн€ | ¬ | завданн€ | ¬ | завданн€ |
| Ca | Fe | In | |||
| Pu | Pb | Ni | |||
| Br | Ba | Y | |||
| Ce | Xe | Ag | |||
| Cd | Gd | I |
«авданн€ ≤≤≤
як≥ з атом≥в, символи €ких умовно позначен≥ ј, Ѕ, ¬, √, ƒ, Ї ≥зотопами, а €к≥ Ц ≥зобарами?
| ¬ | завданн€ | ¬ | завданн€ |

| 
| ||

| 
| ||

| 
| ||

| 
| ||

| 
| ||

| 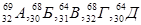
| ||

| 
| ||

|
«авданн€ ≤V
ядро атома маЇ певну к≥льк≥сть нейтрон≥в (n). ≈лектронна оболонка м≥стить певну к≥льк≥сть електрон≥в (ē). який це елемент? Ќапиш≥ть його електронну структуру.
| B | завданн€ | B | завданн€ | B | завданн€ |
| 10 n,9ē | 45 n,34ē | 52 n,41ē | |||
| 39 n,31ē | 30 n,25ē | 78 n,55ē | |||
| 42 n,33ē | 50 n,39ē | 55 n,43ē | |||
| 22 n,18ē | 125 n,85ē | 74 n,53ē | |||
| 57 n,45ē | 66 n,49ē | 58 n,45ē |
«авданн€ V
ћаса €дра атома де€кого ≥зотопу р≥вна m€. ¬ електронн≥й оболонц≥ атома м≥ститьс€ певна к≥льк≥сть електрон≥в (ē). ¬каж≥ть:
|
|
|
а) ск≥льки протон≥в ≥ нейтрон≥в Ї в €др≥ атома;
б) €кий це елемент?
Ќапиш≥ть електронну структуру цього атома.
| ¬ | завданн€ | ¬ | завданн€ | ¬ | завданн€ |
| m€=91; 40ē | m€=152; 63ē | m€=99; 43ē | |||
| m€=128; 52ē | m€=121; 51ē | m€=80; 35ē | |||
| m€=115; 49ē | m€=75; 33ē | m€=85; 37ē | |||
| m€=137; 56ē | m€=184; 74ē | m€=96; 42ē | |||
| m€=88; 38ē | m€=93; 41ē | m€=70; 31ē |
ќ —»ƒ»
(лабораторна робота)
ѕрограмн≥ питанн€
1. ¬изначенн€ пон€тт€ ДоксидиФ.
2. ’≥м≥чн≥ формули оксид≥в.
3. ласиф≥кац≥€ оксид≥в (солеутворююч≥: основн≥, кислотн≥, амфотерн≥; несолеутворююч≥).
4. ’арактер оксид≥в в групах, п≥дгрупах та пер≥одах.
5. Ќоменклатура оксид≥в.
6. ‘≥зичн≥ та х≥м≥чн≥ властивост≥ оксид≥в.
7. ќдержанн€ оксид≥в.
8. ислотно-основн≥ взаЇмод≥њ (вм≥ти писати р≥вн€нн€ реакц≥й взаЇмод≥њ м≥ж собою речовин основного, кислотного ≥ амфотерного характеру).
Ћ≥тература:
[3], [7], [8]






