Мета роботи: Вивчення видів мікроскопії, методів мікроскопіювання, класифікації мікроскопіювальної техніки та будови світлового мікроскопа.
Теоретичні основи: Вивчення морфології та будови клітин мікроорганізмів, розміри яких вимірюються у більшості випадків мікрометрами (1 мкм = 10-3 мм), можливе тільки за допомогою мікроскопів, які забезпечують збільшення об'єктів у тисячі (світлові мікроскопи) та десятки і сотні тисяч разів (електронні мікроскопи).
За допомогою мікроскопа вивчається морфологія та будова клітин мікроорганізмів, їх ріст, розвиток, первинна ідентифікація тощо.
Мікроскопія в темному полі
В основі методу лежить явище Тиндаля - освітлення об'єкта косими променями світла. Ці промені, не потрапляючи в об'єктив, залишаються невидимими для ока, тому поле зору виглядає темним. В той же час оптично неоднорідні клітини, що знаходяться в полі зору і потрапляють в зону проходження променів, відхиляють їх так, що промені попадають в об'єктив. Оскільки промені світла ідуть саме від об'єктів, спостерігач бачить їх в темному світлі у вигляді променів, що інтенсивно світяться. Метод використовується при дослідженні живих клітин мікроорганізмів. Особливо він корисний для функціонально-морфологічного вивчення великих об'єктів, таких як дріжджі.
Фазово-контрастна мікроскопія
Людське око розрізняє тільки довжину (колір) і амплітуду (інтенсивність, контрастність) світлової хвилі, але не вловлює фазових відмінностей.
Майже всі живі клітини прозорі, так як світлові промені, проходячи через них, не змінюють своєї амплітуди, хоча і змінюються за фазою. Метод фазово-контрастної мікроскопії розроблено для спостереження за прозорими об'єктами. Він ґрунтується на перетворенні невидимих для людського ока фазових змін світлової хвилі, які відбуваються при її проходженні через об'єкт, у видимі амплітудні з допомогою спеціального оптичного пристрою.
Метод застосовують для дослідження живих клітин мікроорганізмів, контрастність яких досягається оптичним шляхом без втручання в фізіологічні процеси об'єктів, що вивчаються.
Люмінісцентна або флуоресцентна мікроскопія
Деякі біологічні об'єкти здатні поглинати світло і потім випромінювати промені з більшою довжиною хвилі. При цьому клітини немов би світяться жовто-зеленим або помаранчевим світлом. Це так звана власна, або первинна, люмінесценція.
Нелюмінесцентні об'єкти можна обробити спеціальними флуорохромами (акридином жовтим, акридином помаранчевим, аураміном, примуліном, тіофлавіном, конго червоним, тетрацикліном) і також спостерігати люмінесценцію. Це, так звана, наведена або вторинна люмінесценція.
Люмінесцентна мікроскопія у порівнянні зі звичайною дозволяє: поєднувати кольорове зображення і контрастність об'єктів; вивчати морфологію живих і мертвих клітин мікроорганізмів у поживних середовищах і тканинах тварин та рослин; досліджувати клітинні мікроструктури, які вибірково поглинають різні флуорохроми; визначати функціонально-морфологічні зміни клітин; використовувати флуорохроми при імунологічних реакціях і підрахунку бактерій в зразках з невисоким їх вмістом.
Електронна мікроскопія
За схемою будови електронний мікроскоп аналогічний світловому, але на досліджуваний об'єкт подається не світло, а потік електронів від вольфрамової нитки, що нагрівається електричним струмом.
Роздільна здатність сучасних електронних мікроскопів - 0,2-0,4 нм, робоче збільшення в середньому - 100 000 разів.
Трансмісійний електронний мікроскоп широко застосовується в біологічних дослідженнях. Кожен електронний мікроскоп складається з джерела електронів; електромагнітних котушок, які виконують роль конденсаторної, об'єктивної і проекційної лінз; предметного столика; екрана для зображення і окуляра. Для роботи мікроскопа необхідна вакуумна помпа, оскільки рух електронів можливий тільки у вакуумі. Електрони у трансмісійному мікроскопі рухаються таким же шляхом, як і промені світла у світловому мікроскопі.
Зображення об'єкта можна сфотографувати, якщо замінити екран (металеву пластинку, покриту тонким шаром сульфіду цинку чи сульфіду цинку з селенідом кадмію) фотопластинкою.
Препарати для електронно-мікроскопічних досліджень поміщають на спеціальні сітки, на які нанесена тонесенька плівка (підкладка). Загальна товщина препарату не повинна перевищувати 0,25 мкм.
При дослідженні морфологічних особливостей клітин мікроорганізмів під електронним мікроскопом вивчають цілі клітини і їх зрізи, товщина яких не повинна перевищувати 0,8-0,9 мкм.
Контрастність забезпечується напиленням об'єкта важкими металами (хромом, золотом, паладієм) чи обробкою контрастуючими речовинами типу фосфорно-вольфрамової кислоти і уранілацетату.
Скануючий, або растровий, електронний мікроскоп дає об'ємне зображення досліджуваного об'єкта. В скануючих мікроскопах рухомий тонкий електронний промінь дуже швидко і послідовно оббігає поверхню досліджуваного зразка по квадратному растру і передає отриману інформацію на електронно-променеву трубку, покриту люмінофором, який світиться під дією електронів
Препарати для скануючого мікроскопа піддають спеціальній обробці, основна мета якої - обезводнення об'єкта. Потім препарат покривають тонким шаром сплаву золота чи платини, що робить поверхню зразка електропровідною і дозволяє уникати накопичення електричного заряду, який може знизити розрізнюючу здатність мікроскопа.
При роботі з електронним мікроскопом слід особливо дотримуватись правил техніки безпеки.
Світлова мікроскопія.
Найбільш зручними мікроскопами, призначеними для мікробіологічних досліджень, є мікроскопи типу МБД-1, МБР-1 та МБР-1А (рисунок 1.1). Вони складаються з механічної та оптичної частин. Механічна частина мікроскопа МБР-1 включає штатив з предметним столиком і тубус.
Предметний столик може переміщуватися у горизонтальній площині
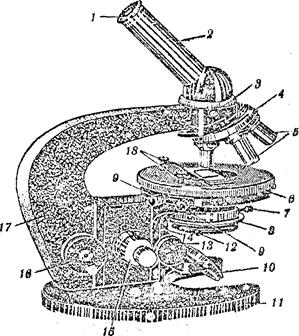
1 - окуляр; 2 - нахилений тубус; 3 - гвинт для кріплення тубуса; 4 – револьвер; 5 – об’єктиви; 6- предметний столик; 7- гвинтдля закріплення конденсора у гільзі; 8 - конденсор; 9 - гвинти для переміщення предметного столика, 10 — дзеркало; 11- підковоподібна основа мікроскопа; 12 - рукоятка ipисової діафрагми конденсора; 1З —рукоятки переміщення конденсорів; 14 - кронштейн конденсора, 15 - рукоятка мікрометричного гвинта; 16 - рукоятка мікрометричного гвинта; 17 – тубусотримач; 18 - клеми для притискання препарату.
Рисунок 1.1 - Мікроскоп МБР-1
на 8 мм за допомогою двох гвинтів, які знаходяться справа та зліва, а також обертатися навколо своєї осі. Це дає можливість провести будь-яку точку препарату у центр поля зору. На поверхні столика є дві клеми, які затискують препарат Під предметним столиком закріплено кронштейн конденсора, який може переміщуватися у межах 20мм спеціальним гвинтом, розміщеним справа.
Верхня частина штатива - тубусотримач (11) — має форму дуги та може переміщуватися на 50 мм обертанням макрометричного (12) та мікрометричного (13) гвинтів, які призначені для грубогота точного фокусування препарату.
У верхній частині тубусотримача знаходиться револьвер (14), який обертається навколо своєї осі. У отвори револьвера вгвинчуються об'єктиви (15) та гніздо для кріплення прямого або похилого тубуса (16). У верхній кінець тубуса вставлений окуляр (18).
Оптична частина мікроскопа складається з освітлювального апарата, об'єктива (15) та окуляра (18). Освітлювальний апарат складається із дзеркала (10) та конденсора (5). Дзеркало регулюється, воно закріплене в основі штатива і має дві сторони: увігнуту та плоску. Увігнуте дзеркало збирає та концентрує у площині препарату пучок паралельних променів, які йдуть від джерела світла, тому ним користуються тільки тоді, коли працюють без конденсора, тобто з малими збільшеннями. При роботі з конденсором слід користуватися тільки плоскою стороною дзеркала. Конденсор складається з двох лінз, за допомогою яких промені, що йдуть від дзеркала, конденсуються та направляються на площину препарату. При мікроскопіюванні з денним світлом конденсор повинен бути піднятий до рівня предметною столика; при штучному освітленні конденсор опускають до тих пір, доки при малому збільшенні зображення джерела світла не з'явиться в площині препарату. Під конденсором знаходиться ірисова діафрагма, яка служить для затримання зайвих променів світла та дозволяє зменшувати апepтypу конденсора (охоплення лінзи).
Об'єктиви - найбільш важлива та цінна частина мікроскопа, яка визначає його оптичну потужність. Вони складаються з системи лінз, які вставлені в металічну оправу.
Біологічні мікроскопи звичайно оснащені трьома змішаними об'єктивами зі збільшенням 8х, 20х, 40х та 90х. Перші три називаються сухими, бо при їх використанні між об'єктом та об'єктивом знаходиться шар повітря (рисунок 1.2. а) При цьому, приймаючи до уваги різницю між показниками приломлення скла препарату (n=1,53) та повітря (n=1,0), частина світлових променів відхиляється і не потрапляє в око спостерігача. Звичайно сухі об'єктиви використовуються при невеликих (400 ¸ 600 разів) збільшеннях.
Об'єктиви зі збільшенням 90х називаються імерсійними (лат. “immеrsio” - занурюю), бо під час роботи вони обов'язково занурюються у імерсійну рідину, яка знаходиться між об'єктивом та об'єктом. Звичайно використовують кедрову олію (n = 1,52), гліцерин (n = 1,4), воду (n = 1,3) та інші речовини, показники заломлення яких близькі до показника приломлення скла. Завдяки цьому, усі промені, не заломлюючись та не змінюючи свого напрямку, потрапляють в об'єктив та забезпечують можливість розглядати найдрібніші об'єкти. Імерсійні об'єктиви дають збільшення до 900¸1350 разів.
Окуляри мікроскопа служать для того, щоб роздивлятися зображення об'єкта, збільшеного за допомогою об’єктива. Окуляри збільшують зображення у 5, 7, 10, 15, 20 разів, що показує цифра, яка вигравірувана на оправі окуляра. Збільшення, яке дає мікроскоп, визначається множенням збільшення об'єктива на збільшення окуляра Так, наприклад, використовуючи окуляр 20х та об'єктив 90х, можна отримати збільшення зображення у 1800 разів.
Збільшення зображення є не єдиною характеристикою мікроскопа. Збільшене зображення може бути як чітким, так і не чітким. Важливим показником мікроскопа є його роздільна здатність, під якою розуміють мінімальну відстань між двома точками, коли вони ще не зливаються в одну. Чим більша роздільна здатність мікроскопа, тим меншої величини об'єкт можна побачити. Роздільна здатність неозброєного ока 200 мкм (0,2 мм).
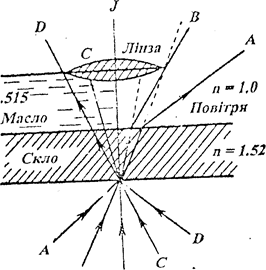
|
В J
a).
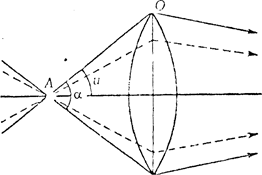
б).
а) Схема ходу променів в сухій та імерсійній системі.
А, В, С, D, J - промені світла;
б) Схема ходу променів при різному значенні кута u.
Α - об'єкт; О – οб’єктив; α - отворовий кут; u - половина отворового кута.
Рисунок 1.2 - Схема ходу променів при мікроскопіюванні
Величина роздільної здатності мікроскопа залежить від довжини хвилі світла, яке використовується, та суми числових апертур об'єктива та конденсора
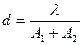 (1.1)
(1.1)
де:
d - мінімальна відстань між двома точками;
A1 - числова апертура об'єктива;
A2 - числова апертура конденсора;
l - довжина хвилі світла, яке використовується.
Числова апертура (А) - це "охоплення" лінзи, вона характеризується кількістю променів, які потрапляють у лінзу. Вона визначається множенням синуса половини (u) отворового кута (a) на показник заломлення (n) середовища, що межує з лінзою (рисунок 1.2. б).
А= sin u × n
Числова апертура будь-якої лінзи, що межує з повітрям, не може бути більше ніж 1, тому що показник заломлення повітря дорівнює 1, а кут u не може бути більше ніж 90о (sin u £ 1).
Величина числової апертури кожного об'єктива показується на його оправі. Сухі системи МБР-1 - 8х та 40х - мають апертуру 0,20 та 0,65 відповідно. Апертура імерсійного об'єктива 90х = 1,25.
Апертура імергованого конденсора мікроскопа МБР-1 = 1,20. Цього значення можна досягти тільки в тому випадку, якщо вмістити імерсійну олію між верхньою лінзою конденсора та нижньою поверхнею предметного скла. Неімергований конденсор має апертуру близько 1.
Простий розрахунок показує, що при освітленні об’єкта світлом з довжиною хвилі 550 нм (0,55 мкм), до якого найбільш чутливе око, роздільна здатність мікроскопа для сухої системи (об'єктив 40х) дорівнює:

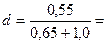 0,33 мкм.
0,33 мкм.
Збільшити роздільну здатність мікроскопа можна двома шляхами: або освітлюючи об'єкт світлом ще коротшої довжини хвилі, наприклад ультрафіолетовим, або збільшуючи показник заломлення середовища, яке межує з лінзою, чого можна досягти, використовуючи імерсійну олію. Тим самим числова апертура об'єктива збільшується до 1,2 (імерсійний об'єктив), а розділення досягає 0,25 мкм.
При роботі з мікроскопом важливе значення має правильне використання конденсора. Неправильне користування ірисовою діафрагмою, необгрунтоване підняття та опускання конденсора приводить до різкого погіршення якості та спотворення мікроскопічної картини.
Оптимально числова апертура конденсора повинна бути такою ж як у об'єктива. У випадку, коли апертура конденсора менша за апертуру об'єктива, остання буде використана не повністю, і роздільна здатність зменшиться. Якщо апертура конденсора більша за апертуру об'єктива, то необхідно дещо прикрити ірисову діафрагму конденсора. Це призведе до усунення розсіяного світла та дасть необхідну контрастність зображення.
Освітлювач - невід'ємна частина мікроскопа. У багатьох сучасних мікроскопах освітлювальний апарат разом із джерелом світла вмонтований у основу мікроскопа. Для мікроскопів,які не оснащені таким пристроєм, використовують спеціальні освітлювачі. Освітлювач ОД-19, який використовується найбільш часто, має низьковольтну лампу (8вольт, 20 Вт) з короткою товстою ниткою.
Лампу включають у мережу через знижуючий трансформатор, у корпусі якого є реостат, що регулює розжарення лампи. Освітлювач встановлюється перед мікроскопом на з'єднувальній планці.
Матеріали, реактиви й устаткування: Світловий мікроскоп, готові препарати мікроорганізмів, імерсійна олія.
Хід роботи:
Розглянути та замалювати препарати мікроорганізмів за допомогою світлового мікроскопа та використовуючи імерсійну олію.
1. Підготувати мікроскоп до роботи. Протерти лінзи окуляра і об'єктива м'якою серветкою, розмістити лампу та мікроскоп так, щоб було зручно для роботи.
2. Підняти конденсор у максимальне верхнє положення, закрити ірисову діафрагму, вивести світлофільтр. Поставити у робоче положення об'єктив 8х.
3. Вийняти окуляр і, дивлячись через тубус у мікроскоп, встановити освітлювач так, щоб джерело світла було чітко видно в центрі поля зору.
4. Встановити окуляр, пересуваючи тубус мікроскопа за допомогою макрометричного гвинта, знайти чітке зображення джерела світла. Ввести світлофільтр і відкрити ірисову діафрагму.
5. При роботі з об'єктивами 8х, 40х та 90х конденсор залишити у максимально верхньому положенні. Ступінь освітлення слід регулювати ірисовою діафрагмою.
6. Покласти предметне скло з препаратом на столик мікроскопа, затиснути його клемами.
7. При роботі з об'єктивом 40х спочатку знайти зображення об'єкта, користуючись об'єктивом 8х і прикриваючи ірисову діафрагму. Потім, не піднімаючи тубус мікроскопа, перевести в робоче положення об'єктив 40х, злегка відкрити діафрагму і знайти зображення об'єкта, користуючись макрометричним і мікрометричним гвинтами.
8. При роботі з об'єктивом 90х на препарат нанести краплю імерсійної, кедрової олії чи гліцерину. Відкрити повністю ірисову діафрагму.
9. Дивлячись збоку, обережно за допомогою макрогвинта опустити тубус мікроскопа так, щоб лінза об'єктива занурилась в імерсійну рідину і злегка доторкнулась поверхні скла. Слід пам'ятати, що при різкому опусканні об'єктива можна роздавити фронтальну лінзу і вивести мікроскоп з ладу.
10. Дивлячись в окуляр, дуже повільно піднімати тубус за допомогою макрогвинта, поки в полі зору не з'явиться зображення досліджуваного об'єкта. Якщо зображення не знайдено, повторити операцію 9 і 10.
11. Поліпшити видимість препарату за допомогою мікрометричного гвинта.
12. Після завершення роботи зняти серветкою імерсійну олію з лінзи об'єктива 90х. Перевести мікроскоп на мале збільшення, дзеркало встановити у вертикальне положення.
Контрольні питання:
1. В чому полягає суть фазово-контрасної, люмінесцентної та мікроскопії в темному полі?
2. Чим відрізняється електронний мікроскоп від світлового?
3. Дайте визначення наступним термінам: роздільна здатність, числова апертура.
4. Що таке імерсійний об’єктив?
5. Будова світлового мікроскопа.
Форма звітного бланка до лабораторної роботи №1.
| Група | Курс | Лабораторна робота №1 | ||||
| Мікроскоп та методи мікроскопіювання | ||||||
| Прізвище студента | ||||||
| 1) Рисунок культури мікроорганізмів …………………………………… при збільшенні (назва препарату мікроорганізмів латинською) а) 8х, б) 40х, в) 90х. 2) Відповідь на контрольні питання. 3) Висновки по лабораторній роботі №1 | ||||||
| Роботу прийняв | Дата | Підпис | ||||
Лабораторна робота №2






